

细胞膜伪装纳米粒子具有源自其膜结构和表面抗原的固有优势,包括在血流中的长时间循环、特定的细胞识别和靶向能力以及免疫治疗的潜力。
2024年6月,四川大学华西医院钱志勇教授团队在Signal Transduction and Targeted Therapy上发表了题为“Genetically programmable cell membrane-camouflaged nanoparticles for targeted combination therapy of colorectal cancer”的研究论文。本研究介绍了一种称为 MPB-3BP@CM NPs 的细胞膜仿生纳米药物平台。该平台利用微孔普鲁士蓝纳米颗粒 (MPB NPs) 作为光热敏化剂和3-溴丙酸 (3BP) 的载体,并将其包裹在表达高亲和力信号调节蛋白 α (SIRPα) 变体的细胞膜中,具有延长血液循环时间、有效靶向大肠癌细胞CD47的能力,并通过阻断 CD47-SIRPα 相互作用增强巨噬细胞对大肠癌细胞的吞噬作用。在体内外实验中显示出显著的抗肿瘤活性和极低的全身毒性,为提高结直肠癌治疗的疗效和安全性提供了新的视角。拜谱生物为该研究成果提供了能量代谢绝对定量技术,这项研究的结果为工程化疾病定制细胞膜用于肿瘤治疗引入了一种通用方法。


文章名称:Genetically programmable cell membrane-camouflaged nanoparticles for targeted combination therapy of colorectal cancer(Signal Transduction and Targeted Therapy,IF=39.3,2024.6)
客户单位:四川大学华西医院
研究材料:小鼠皮下组织&贴壁培养细胞
拜谱提供技术:靶向能量代谢
一、研究结果
01.MPB-3BP@CM NPs的制备和表征
制备MPB-3BP@CM NP的第一步是合成MPB NP。MPB NPs纳米结构的多孔特性,这对高效载药至关重要。3BP被称为“代谢灾难”,对糖酵解具有抑制作用,在诱导肿瘤细胞凋亡以及在临床前研究中预防肿瘤生长方面表现出显着的功效。随后,将3BP加载到MPB NPs腔中,得到MPB-3BP NPs。为了制备CM-MSIRPα,将DsRed蛋白与MSIRPα受体(DsRed-MSIRPα)融合以提供红色荧光。随后,建立了稳定的人胚胎肾293 T(HEK 293 T)细胞系,在其细胞膜上表达MSIRPα受体(HEK 293T-MSIRPα)。为了提取纯化的CM-MSIRPα,培养HEK 293T-MSIRPα细胞,并进行纯化过程。为了将CM-MSIRPα涂覆在MPB-3BP NPs的表面,将两种组分共挤出400和200 nm聚碳酸酯多孔膜,得到MPB-3BP@CM NPs(图1)。
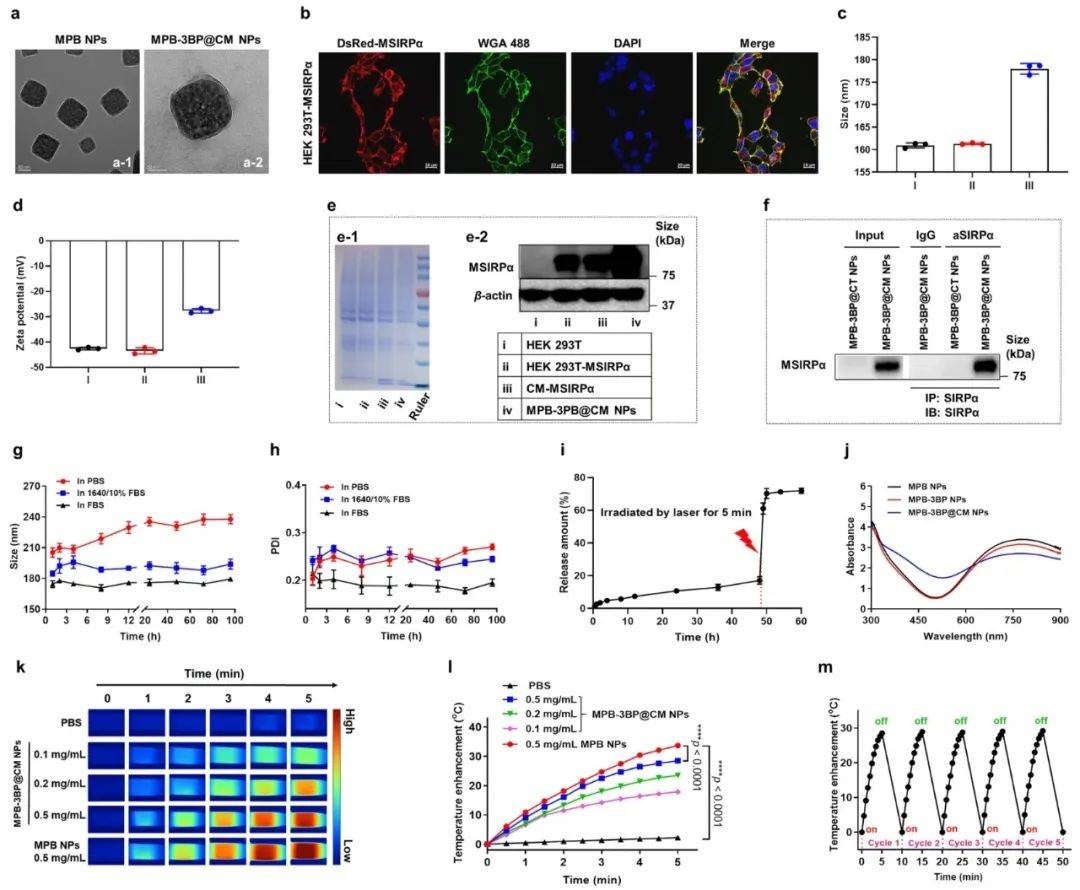 图1|MPB-3BP@CM NPs的表征
图1|MPB-3BP@CM NPs的表征
02.细胞结合和摄取、体外毒性及抗肿瘤效果
癌细胞采用各种策略来逃避免疫监视和吞噬作用,其中之一涉及CD47配体的上调。这些配体与SIRPα受体相互作用,传递“不要吃我”的信号,抑制巨噬细胞吞噬癌细胞。为了研究MPB-3BP@CM NPs是否可以通过MSIRPα-CD47相互作用与结直肠癌(CRC)细胞结合,使用蛋白质印迹分析选择表达CD47的人CRC癌细胞系HCT116,然后在体外孵育MPB-3BP@CM NPs。结果显示,在孵育期2小时后,MPB-3BP@CM NPs与HCT116细胞的细胞膜表面有牢固的结合。此外,免疫共沉淀法(CO-IP)进一步证实MSIRPα与CD47之间的分子相互作用。总的来说,这些结果说明了MPB-3BP@CM NPs(在其表面呈递MSIRPα受体)与HCT116细胞之间通过MSIRPα和CD47之间的结合而有效的相互作用,且HCT116细胞在摄取MPB-3BP@CM NPs方面表现出显著的效率(图2a-f)。
在体内治疗前,先对MPB-3BP@CM NPs进行体外细胞毒性评价。溶血试验和甲基噻唑四氮唑(MTT)试验均证实其良好的血液和生物相容性。进一步使用MTT法评估MPB-3BP@CM NPs的抗肿瘤效率,结果表明,MPB-3BP@CM NPs联合激光照射具有较强的抗癌活性,与同等剂量的光热剂治疗和其他激光组相比,其治疗效果显著提高。总的来说,优越的抗癌功效可归因于MPB-3BP@CM NPs的细胞摄取增强,以及MPB-3BP@CM NPs的化疗/PTT联合治疗。此外,含3BP的制剂对HCT116细胞的杀伤效果明显优于不含3BP的其他制剂,显示3BP介导的糖酵解抑制在体外诱导肿瘤细胞毒性中起重要作用。为了验证MPB-3BP@CM NPs破坏肿瘤糖酵解途径的功效,评估了MPB-3BP@CM NPs治疗后不同时间培养的HCT116细胞中ATP和乳酸水平。经过一段较长的时间(14小时)后,细胞表现出明显的凋亡,同时ATP和乳酸水平显著降低。总之,结果表明MPB3BP@CM NPs具有调节肿瘤糖酵解代谢的能力,并有效地减弱HCT116细胞中ATP和乳酸的产生(图2g-i)。
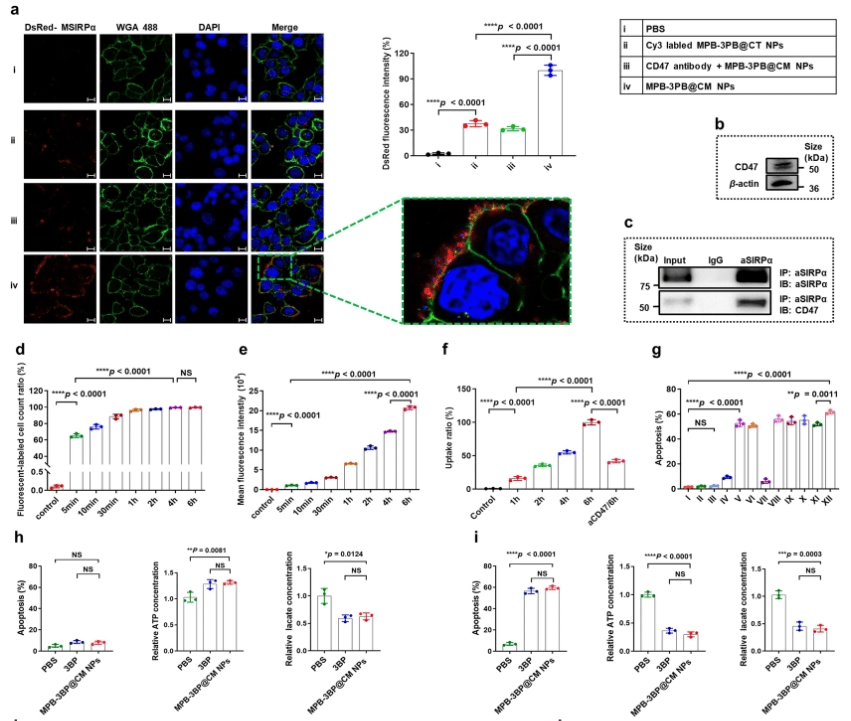 图2a-i|细胞的结合和摄取、体外毒性及抗肿瘤效果
图2a-i|细胞的结合和摄取、体外毒性及抗肿瘤效果
03.细胞糖酵解途径的调节
接下来对MPB-3BP@CM NPs (200 μg/mL)作用8小时的HCT116细胞进行了葡萄糖代谢物分析和转录谱分析。选择这个特定的时间点是为了尽量减少凋亡过程可能产生的干扰。与对照组相比,3BP组和MPB-3BP@CM NPs组在细胞葡萄糖代谢物方面都表现出了显著变化(图2j)。ATP和乳酸含量的测量结果与之前的研究结果一致,从而验证了之前结果的可靠性(图2k)。令人惊讶的是,与糖酵解途径相关的代谢物显著积累,而与三羧酸循环途径相关的代谢物显著减少。此外,多种细胞能量代谢相关物质,包括二磷酸腺苷(ADP)、二磷酸鸟苷(GDP)、烟酰胺腺嘌呤二核苷酸磷酸(NADPH)均显著降低。根据KEGG通路分析(图2l),与代谢相关的差异表达基因主要富集于淀粉和蔗糖代谢、肌醇磷酸代谢、糖酵解/糖异生和半乳糖代谢。热图显示了这些具有代表性的差异表达基因的表达水平(图2m)。这些发现为MPB-3BP@CM NPs组中葡萄糖代谢物的差异提供了进一步令人信服的证据。
 图2j-m|MPB-3BP@CM NPs有效调节肿瘤糖代谢
图2j-m|MPB-3BP@CM NPs有效调节肿瘤糖代谢
04.诱导有效的免疫反应
肿瘤微环境(TME)中乳酸水平升高与促进血管生成、转移和免疫抑制有关,尤其重要的是与肿瘤相关巨噬细胞(TME)的浸润和激活有关。考虑到MPB-3BP@CM NPs降低HCT116细胞乳酸生成的能力,研究了MPB-3BP@CMPs介导的肿瘤糖代谢的有效调节是否可以促进TAM向抗致瘤M1表型的极化。
在体外将RAW 264.7巨噬细胞与差异处理的HCT116癌细胞共培养。与对照组相比,MPB-3BP@CM NPs和MPB-3BP@CM NPs +激光组巨噬细胞中M1标记物CD86水平升高,M2标记物CD206水平降低(图3a, b)。此外,细胞因子的定量(包括作为M1表型标记的IL-12和IL-6,作为M2表型标记的TGF-β和IL-10)进一步验证了MPB-3BP@CM NPs介导的对肿瘤糖代谢的干扰在体外有效诱导了TAM向M1表型的极化(图3c-f)。Balb/c裸鼠HCT116皮下肿瘤模型中收集肿瘤并进行流式细胞术分析进一步证实了MPB-3BP@CM NPs对高效极化TAM向M1表型的体内影响。肿瘤切片免疫荧光染色显示MPB-3BP@CM NPs +激光组M1巨噬细胞(CD86+)计数明显升高;肿瘤组织中IL-6和IL-12 (M1标记物)水平升高,TGF-β和IL-10 (M2标记物)水平降低进一步证实了极化的增加(图3i-p),表明特异性抗肿瘤免疫的增强得到有效实现,刺激巨噬细胞吞噬肿瘤细胞的能力(图3q)。
 图3|体外和体内,MPB-3BP@CM nps诱导巨噬细胞极化和吞噬
图3|体外和体内,MPB-3BP@CM nps诱导巨噬细胞极化和吞噬
02.拜谱小结
近年来,代谢研究一直是肿瘤学领域的一个突出课题。肿瘤细胞独特的代谢模式赋予了肿瘤细胞恶性生物学特性。其中,糖酵解加剧,被称为Warburg效应,是由糖酵解酶失调驱动的一个标志性特征。针对糖酵解过程中涉及的关键酶,如葡萄糖转运蛋白1 (GLUT1)、HK2、丙酮酸激酶M2 (PKM2)和乳酸脱氢酶(LDH)等酶的抑制,可以实现抑制肿瘤增殖、侵袭转移、免疫逃避、血管生成和耐药的有效策略。虽然HK2抑制剂3BP显示出对抗肿瘤的希望,但由于其烷基化性质,其自由形式在全身给药过程中存在不稳定性。为了解决这一挑战,本研究利用MPB NPs进行封装为MPB-3BP@CM NPs,有效地提高了其稳定性、生物相容性、循环时间、肿瘤蓄积等特点。这一过程中拜谱生物提供了能量代谢绝对定量技术,拜谱生物可提供完善成熟的转录组学、蛋白组学、代谢组学以及多组学联合产品技术服务体系,助力高分文章发表,欢迎咨询!
参考文献:Yang Y, Liu Q, Wang M, Li L, Yu Y, Pan M, Hu D, Chu B, Qu Y, Qian Z. Genetically programmable cell membrane-camouflaged nanoparticles for targeted combination therapy of colorectal cancer. Signal Transduct Target Ther. 2024 Jun 12;9(1):158. doi: 10.1038/s41392-024-01859-4.