

Gasdermin D (GSDMD)是细胞焦亡的关键执行者,但是GSDMD的翻译后修饰对细胞焦亡的调控作用仍待探索。2024年2月,浙江大学师福山教授团队在Cell Death& Disease上发表了题为“Crosstalk of HDAC4, PP1, and GSDMD in controlling pyroptosis”的文章。在这项研究中,作者发现GSDMD可以在赖氨酸248残基处发生乙酰化,并且这种乙酰化增强了焦亡。将组蛋白脱乙酰酶 4(HDAC4)确定为负责介导GSDMD脱乙酰化的特异性脱乙酰酶,从而抑制体外和体内的焦亡。GSDMD的去乙酰化会损害其泛素化,从而抑制焦亡。有趣的是,HDAC4的磷酸化作为一种关键的调节机制出现,促进其去乙酰化GSDMD和抑制GSDMD介导焦亡的能力。拜谱生物为该研究提供LC-MS/MS蛋白质谱分析,揭示了一个涉及HDAC4、PP1和GSDMD的复杂调控网络。这些发现为乙酰化、泛素化和磷酸化在焦亡调节中的相互作用提供了有价值的见解,为炎症细胞死亡领域的进一步研究提供了潜在的靶点。

文章名称:Crosstalk of HDAC4, PP1, and GSDMD in controlling pyroptosis(Cell Death& Disease,IF=9.2,2024.2)
客户单位:浙江大学
研究材料:人源IP蛋白
拜谱提供技术:LC-MS/MS蛋白质谱分析
一、研究结果
01.GSDMD的K248残基的乙酰化调节焦亡
作者通过前期实验发现,GSDMD的乙酰化促进细胞焦亡。为了确定GSDMD中潜在的乙酰化位点,作者对经过TSA处理的HEK293T细胞中获得的Flag-GSDMD进行了质谱分析,并使用软件预测赖氨酸修饰位点。结果发现四种潜在的赖氨酸残基:K103、K145、K248和K387。序列比较发现,Lys103、Lys145和Lys248是GSDMD同源物中保守的乙酰化基序。因此,作者基于GSDMD全长或GSDMD-p30构建了几个突变体(K103R,K145R,K248R和K387R)。结果表明,赖氨酸248在GSDMD中作为乙酰化位点起着关键作用(图1A-D)。此外,GSDMD-KO THP-1细胞中GSDMD-K248R的重建导致的细胞死亡比GSDMD-WT更轻(图1E-F)。此外,作者还开发了GSDMD的结构模型,其乙酰基连接到K248残基上(图1G)。免疫荧光分析表明,与GSDMD-WT相比,GSDMD-K248R不影响其定位(图1H)。因此,这些发现表明Lys248是乙酰化最关键的残基之一。
 图1| GSDMD在赖氨酸248处发生乙酰化(图源:Xu W., et al., Cell Death Dis., 20
图1| GSDMD在赖氨酸248处发生乙酰化(图源:Xu W., et al., Cell Death Dis., 20
02.HDAC4抑制GSDMD介导的焦亡
如前所述,GSDMD的乙酰化在TSA处理时显著增加,表明了HDAC家族脱乙酰酶的参与。为了鉴定GSDMD的特异性脱乙酰酶,作者对有或没有TSA处理的标记GSDMD进行了质谱分析,该分析表明HDAC4为GSDMD的特异性脱乙酰酶(图2A)。免疫共沉淀分析证实了GSDMD和HDAC4在HEK293T细胞中存在显著相互作用(图2B),作者还在THP-1细胞中以及猪和小鼠中观察到这种相互作用(图2C)。作者进一步研究了HDAC4对不同物种GSDMD诱导的焦亡的影响。结果表明,HDAC4显著抑制了来自不同物种的GSDMD诱导的焦亡(图2F),此外作者在体外实验中也得到了相同的结果。
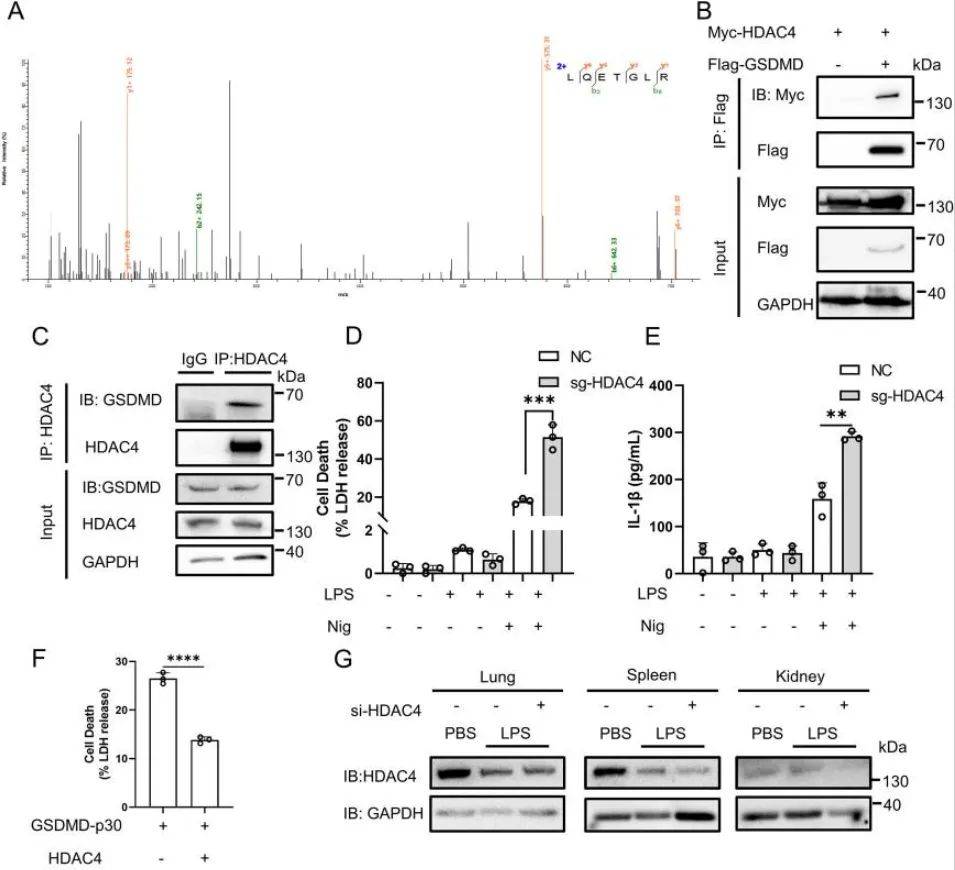 图2| HDAC4抑制细胞焦亡(图源:Xu W., et al., Cell Death Dis., 2024)
图2| HDAC4抑制细胞焦亡(图源:Xu W., et al., Cell Death Dis., 2024)
03.蛋白磷酸酶1(PP1)调节HDAC4的磷酸化
作者通过实验Ser 246、Ser 467和Ser 632这三个磷酸化位点对HDAC4的去乙酰化活性很重要。由于HDAC4的磷酸化与其去乙酰化能力相关,且有文献报道蛋白磷酸酶1(PP1)负责调控GSDMD磷酸化并抑制焦亡。鉴于HDAC4也抑制细胞焦亡,作者假设PP1与HDAC4相互作用。结果证实HDAC4确实与PP1相互作用,类似于它与GSDMD的相互作用。随后作者通过PP1抑制剂冈田酸(OA)处理实验以及转染实验表明了PP1通过使HDAC4去磷酸化参与GSDMD脱乙酰化的过程。
作者随后探讨了GSDMD的乙酰化和泛素化之间的关系。通过TSA处理、HDAC4转染实验以及构建乙酰化模拟突变体发现GSDMD的乙酰化促进了其泛素化,这反过来又促进了GSDMD介导的细胞焦亡,乙酰化和泛素化在调节GSDMD功能方面存在调节串扰。
二、 拜谱小结
在这项研究中,研究团队揭示了一种以前未知的GSDMD翻译后修饰,并阐明了GSDMD、HDAC4和PP1在焦亡调节中的新相互作用。GSDMD和HDAC4的翻译后修饰(泛素化、乙酰化和磷酸化),在调节焦亡中起着至关重要的作用。不同PTM之间的相互作用以及HDAC4和PP1的参与增加了焦亡调节的复杂性,并进一步加深了我们对这一重要生物过程的理解。这些发现为细胞焦亡的机制提供了见解,并为干预炎症相关疾病提供了机会。这一过程中拜谱生物提供了LC-MS/MS蛋白质谱分析,拜谱生物可提供完善成熟的蛋白组学、修饰蛋白质组学、代谢组学等多组学产品技术服务,助力发表高分文献,欢迎致电咨询!
参考文献:Xu W, Jin Q, Li X, Li D, Fu X, Chen N, Lv Q, Shi Y, He S, Dong L, Yang Y, Yan Y, Shi F. Crosstalk of HDAC4, PP1, and GSDMD in controlling pyroptosis. Cell Death Dis. 2024 Feb 7;15(2):115. doi: 10.1038/s41419-024-06505-z.