


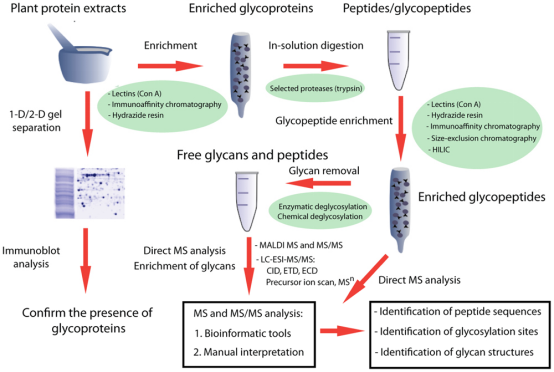
糖分子自身的复杂性和许多N-glycoproteins低表达水平使得对N-glycosylation结构的表征的描述极为困难。在检测低丰度的N糖基化修饰蛋白或肽段时,其中掺杂大量未修饰的蛋白肽断,这很容易将低丰度的糖基化修饰蛋白肽段的信号掩盖。凝素亲和法是目前糖蛋白质组学中应用最广泛的分离富集方法。凝集素(lectin)是一类糖结合蛋白质,能专一识别某一特殊结构的单糖或聚糖中特定的糖基序列而与之结合,它们与糖链可逆非共价结合,糖蛋白或糖肽被凝集素捕获之后,通常用特定的单糖通过竞争结合凝集素将糖蛋白或糖肽洗脱下来。
蛋白质经过酶解后利用凝集素(lectin)富集N-糖基化肽段,然后用N-糖酰胺酶(PNGase)在H218O中切除连接在天冬酰胺残基(Asn)上的糖链。该处理致使Asn分子量增加2.9890Da。最后用高精度LC-MS质谱仪检测脱糖后的肽段,通过检索数据库,确认脱糖后分子量与其理论分子量的变化以及糖基化修饰肽段的序列,从而确定该蛋白质的N-糖基化位点。N-糖基化位点确定之后,再利用label-free的原理对其进行定量分析。
| 样本类型 | 常规送样量 |
| 植物叶片 | 湿重≥3g |
| 植物根茎、木质部、韧皮部等 | 湿重≥5g |
| 细胞样品 | 细胞量湿重≥5*10^7 |
| 组织样品 | 人、动物、微生物湿重≥50mg |
| 体液样品 | 血清、血浆体积≥200μl,脑脊液≥500μl,尿液≥1000μl |