

代谢重编程是肿瘤发生和进展的标志,葡萄糖代谢的改变起着核心作用。这种转变使肿瘤细胞能够快速获取能量并产生必需的代谢中间体,从而支持增强生长。尽管具有重要意义,但肿瘤细胞上调糖酵解的机制仍不够了解。
近日,南京医科大学第一附属医院王学浩院士团队在Cancer Letters上发表了“O-GlcNAcylation of YBX1 drives a glycolysis-histone lactylation feedback loop in hepatocellular carcinoma”的研究论文。该研究建立了一个涉及YBX1糖酵解和H3K18乳酸化的正反馈循环,从而加速了HCC的进展。破坏这种反馈循环可能为HCC提供一种新的治疗策略。拜谱生物为该研究提供了转录组测序,蛋白互作组和靶向能量代谢检测分析服务。

英文标题:O-GlcNAcylation of YBX1 drives a glycolysis-histone lactylation feedback loop in hepatocellular carcinoma(Cancer Letters IF:10.1)
中文标题:YBX1的O-乙酰葡糖胺化修饰驱动肝细胞癌中糖酵解-组蛋白乳酸化反馈环路
客户单位:南京医科大学
研究材料:细胞
拜谱提供服务:转录组测序+蛋白互作组+靶向能量代谢组
技术路线:

研究结果
01、YBX1被鉴定为HCC中糖酵解的关键基因
本研究采集HCC肿瘤样本(n=7)的单细胞RNA测序数据集进行分析,发现糖酵解活性主要集中在肿瘤细胞中,hdWGCNA分析识别出9个基因模块(图1A-G)。TCGA-LIHC队列的生存分析确定YBX1为独立生存风险因素(图1H)。进一步结合IHC、WB实验和肿瘤组织与邻近非肿瘤组织的空间转录组学数据集证实YBX1是肝细胞癌治疗的潜在靶点(图1I-K)。
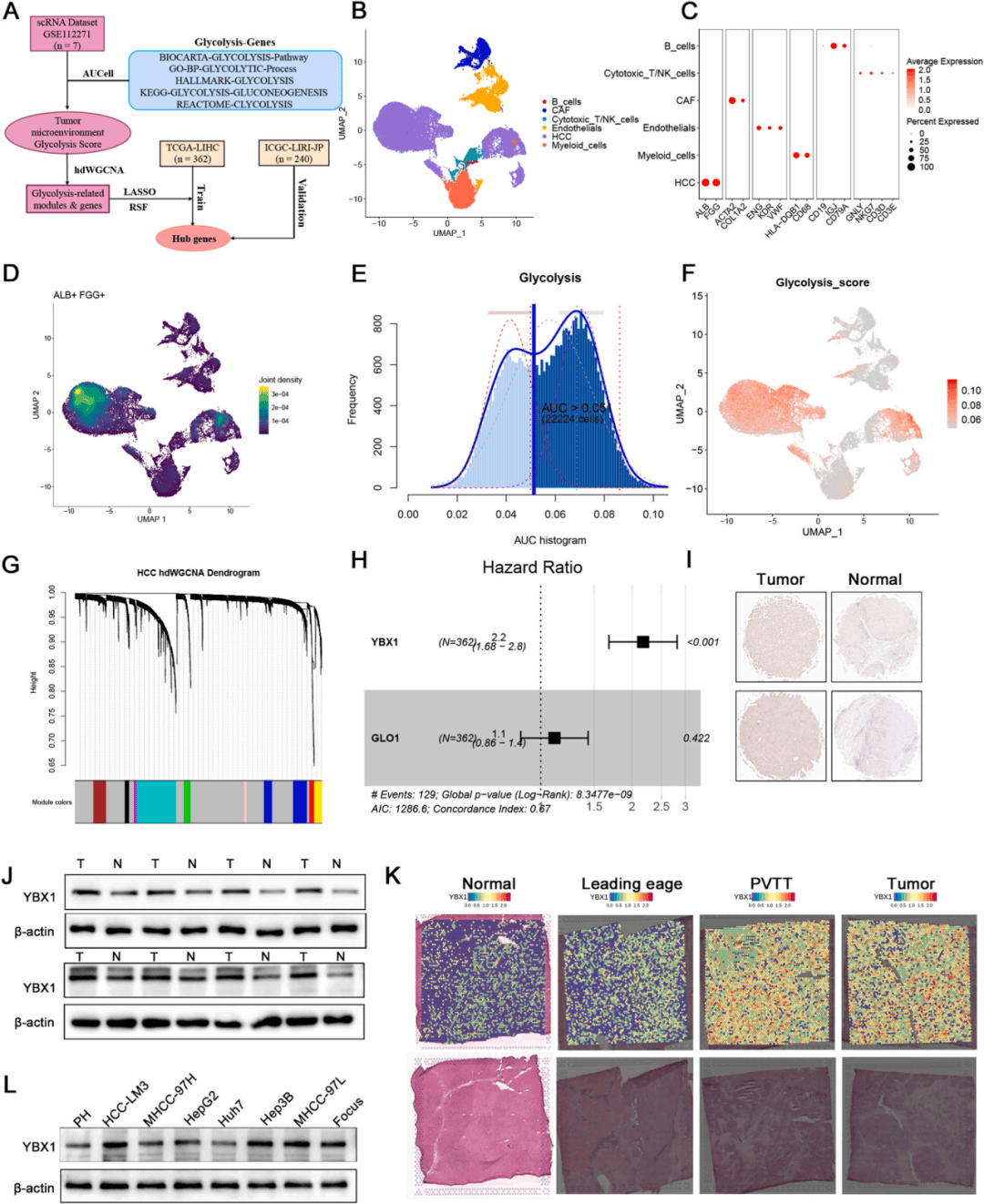 图1:YBX1被确定为调节HCC细胞糖酵解的关键因素
图1:YBX1被确定为调节HCC细胞糖酵解的关键因素
02、YBX1促进HCC中的有氧糖酵解和增殖
为了研究YBX1在调控HCC糖酵解中的作用。构建YBX1敲低细胞系,靶向能量代谢组学检测,敲低后糖酵解途径的几个关键中间体显著减少,三羧酸(TCA)循环中间体的水平也降低了(图2A-D);结合葡萄糖碳示踪法、细胞外酸化率检测等实验证实YBX1敲低后,糖酵解活性受损,葡萄糖摄取和乳酸分泌减少,抑制HCC细胞增殖(图2E-K)。
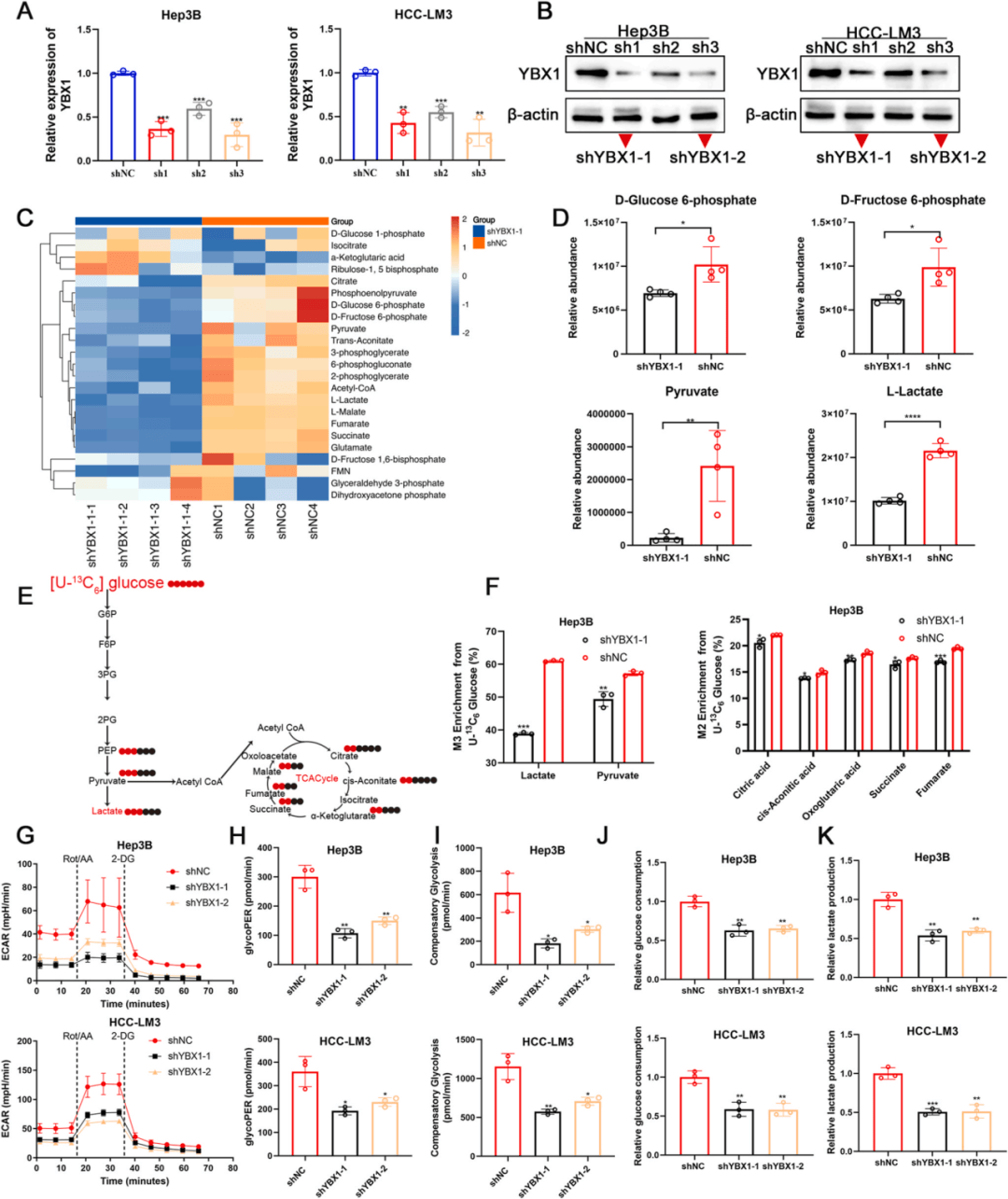 图2:YBX1促进HCC中的有氧糖酵解和增殖
图2:YBX1促进HCC中的有氧糖酵解和增殖
03、OGT与YBX1结合并促进YBX1的O-GlcNAc糖基化
为了识别YBX1的调控因子,蛋白互作组分析显示YBX1与O-GlcNAc转移酶(OGT)相互作用,并结合Co-IP和共定位进行验证(图3A–E)。进一步创建了一个OGT K908A突变体,利用O-GlcNAc糖基化激活剂、抑制剂OSMI-1判断YBX1的O-GlcNAc糖基化的变化(图3F-H),结构域分析OGT的TPR结构域对于与YBX1的结合至关重要(图3I-L)。免疫沉淀YBX1的质谱分析揭示了六个潜在的O-GlcNAc糖基化位点,并结合点突变和分析证实T57是YBX1上关键的O-GlcNAc糖基化位点(图3M-O)。
 图3:OGT与YBX1结合并促进YBX1的O-GlcNAc糖基化
图3:OGT与YBX1结合并促进YBX1的O-GlcNAc糖基化
04、YBX1的O-GlcNAc糖基化增强其磷酸化,从而促进其核转位
进一步检测YBX1的O-GlcNAc糖基化是否影响其磷酸化,在OGT敲低的HCC细胞中或用OGT抑制剂OSMI-1处理,YBX1蛋白水平显著降低,YBX1磷酸化显著减少(图4A-C)。IP实验显示,在相同的Flag-YBX1底物水平下,YBX1-WT的磷酸化水平显著高于YBX1-T57A,表明磷酸化的增加不仅仅是因为更高的YBX1蛋白表达(图4D)。分离了核和质组分发现TMG处理的HCC细胞中YBX1核表达的升高(图4E-F),进一步发现YBX1磷酸化的关键调节因子是AKT(图4G-I)。这些发现强调O-GlcNAc糖基化通过促进其磷酸化来增强YBX1蛋白稳定性并促进核转位。
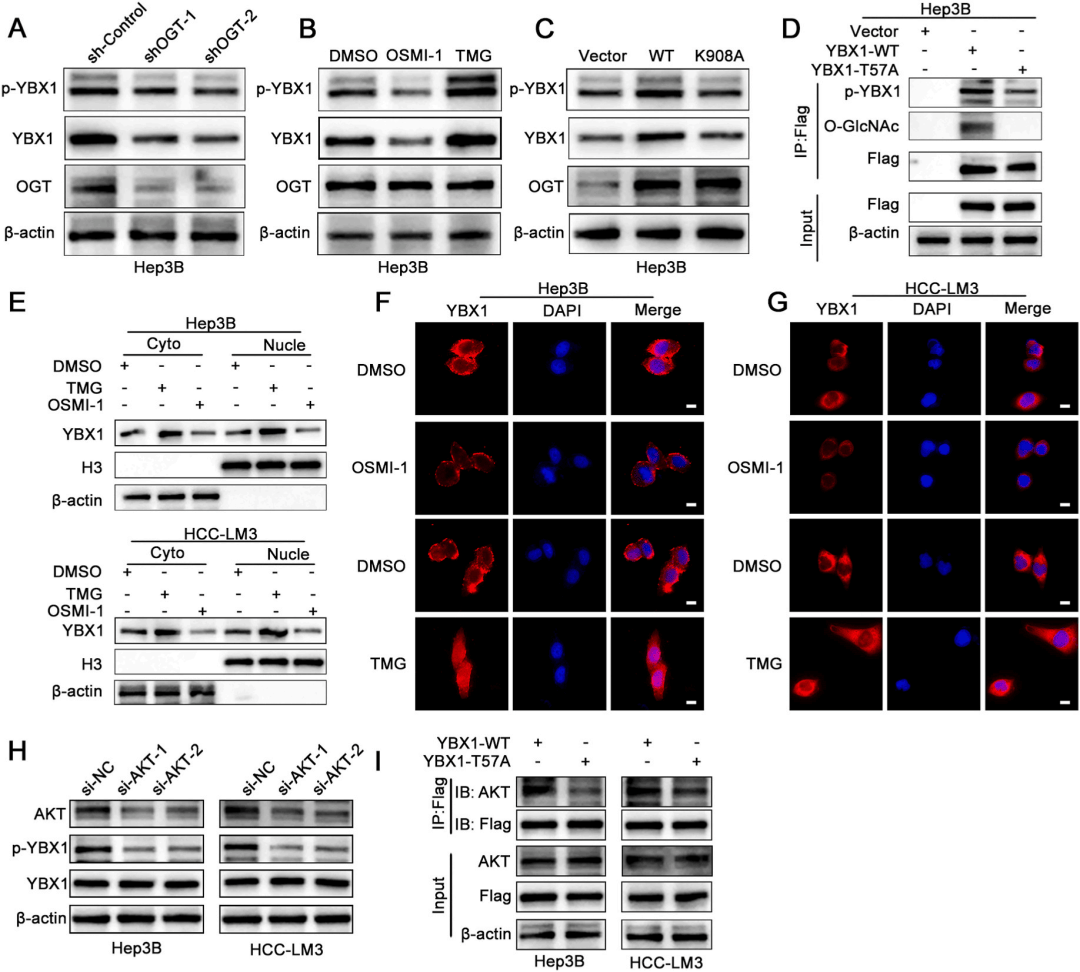 图 4.YBX1的 O-GlcNAc 修饰有利于其进一步发生磷酸化修饰并能够促进其核转位
图 4.YBX1的 O-GlcNAc 修饰有利于其进一步发生磷酸化修饰并能够促进其核转位
05、YBX1促进PKM2转录
前期结果表明YBX1 O-GlcNAc糖基化通过增强糖酵解和细胞增殖促进HCC进展。为了研究YBX1如何调控糖酵解,我们在HCC细胞中进行了转录组测序分析,糖酵解相关基因集在YBX1敲低细胞中显著抑制(图5A-B)。RNA 测序数据和 CUT&Tag 数据集以及ChIP-qPCR、QRT-PCR 分析表明PKM2 和 LDHA 是 YBX1 的直接转录靶标(图5C-H)。
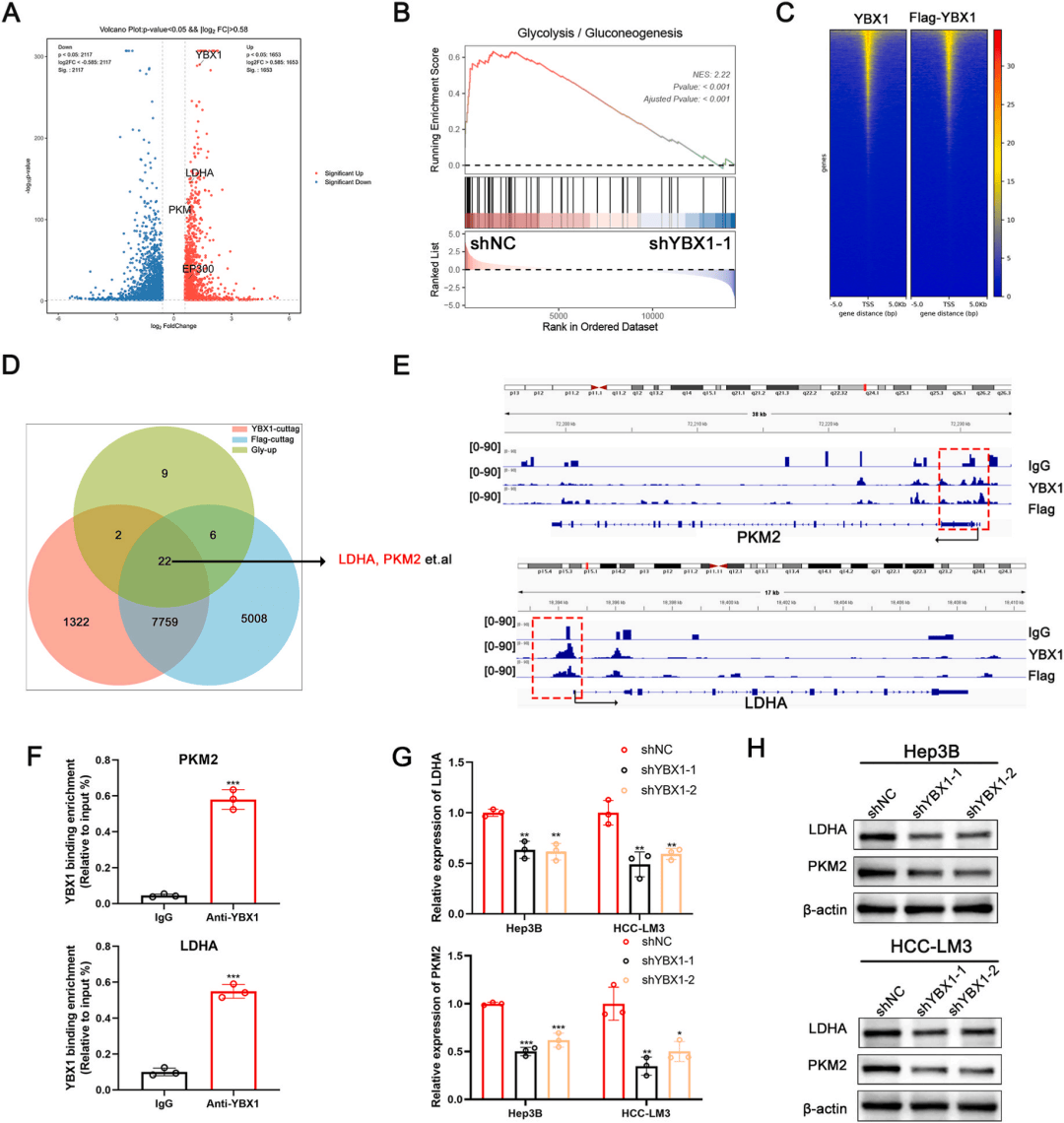 图 5.YBX1促进PKM2转录
图 5.YBX1促进PKM2转录
06、YBX1 能够提高组蛋白乳酸化修饰水平
研究发现YBX1敲低显著降低蛋白质乳酸化,尤其是H3K18乳酸化(图6A-C)。糖酵解抑制剂2-DG的实验证实了糖酵解与组蛋白乳酸化的直接关联,抑制糖酵解可显著降低H3K18la水平(图6D)。PKM2过表达可逆转YBX1敲低所致的H3K18la下降,而外源乳酸处理不仅提升H3K18la,还伴随YBX1表达上调,提示存在正向反馈(图6E-G)。CUT&Tag与ChIP-PCR证实,H3K18la通过富集于YBX1启动子直接促进其转录,该过程受O-GlcNAc糖基化调控(图6H-J),并发现P300 上调是YBX1增强H3K18乳酰化作用的机制(图6K-L)。
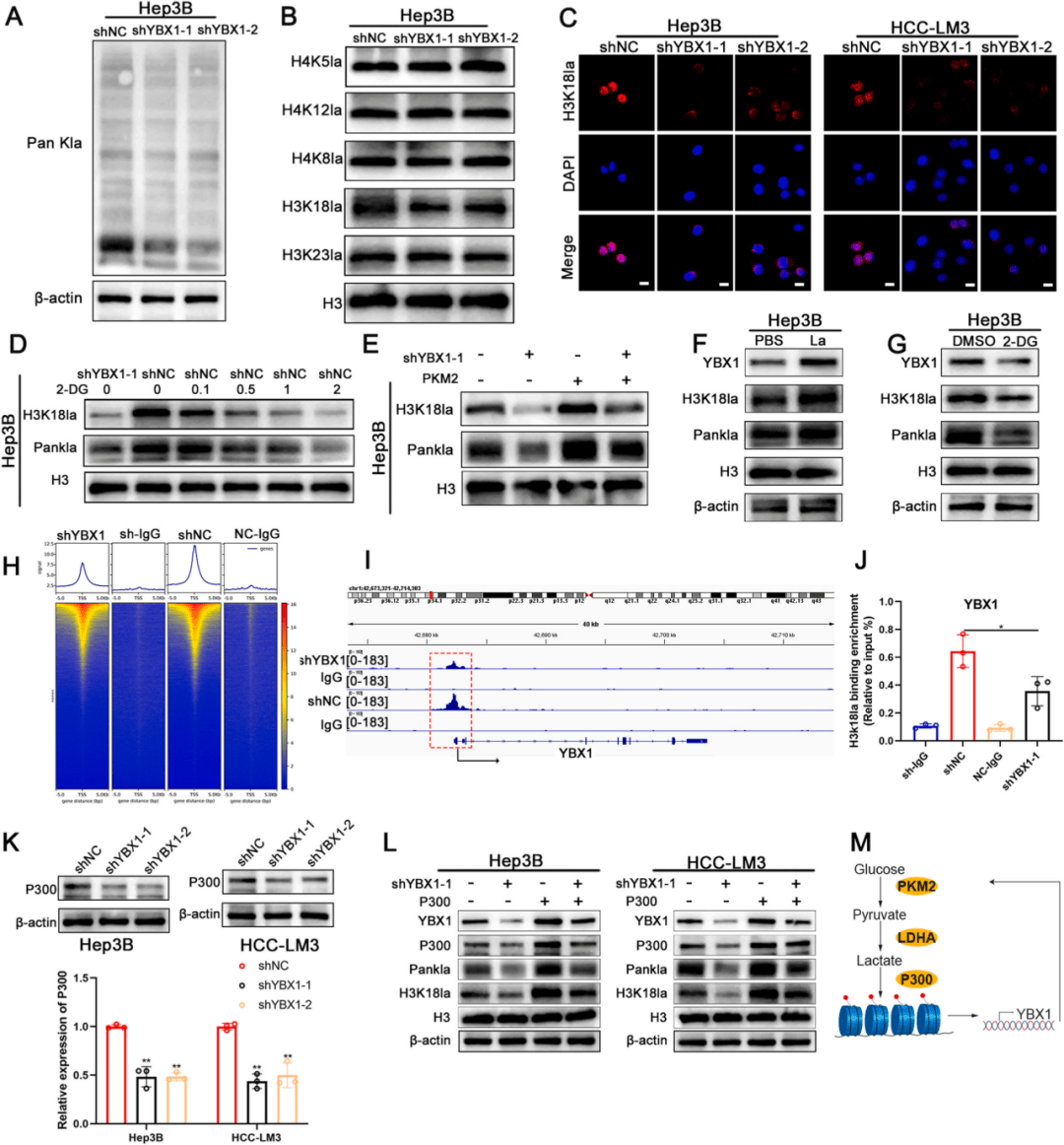 图6.YBX1增强H3K18乳酸化修饰水平
图6.YBX1增强H3K18乳酸化修饰水平
文章小结
在这项研究中报道了YBX1在HCC中高表达,并且与糖酵解密切相关。YBX1在T57处被O-GlcNAc修饰,从而稳定蛋白质并增加其表达。这种修饰还促进YBX1在T57处的磷酸化,促进其核易位。因此,这一过程增强了糖酵解相关基因的转录并刺激乳酸的产生。此外,YBX1激活P300的转录,进而驱动组蛋白的乳酸化,特别是H3K18la,H3K18乳酸化正向调控YBX1基因转录(图7)。
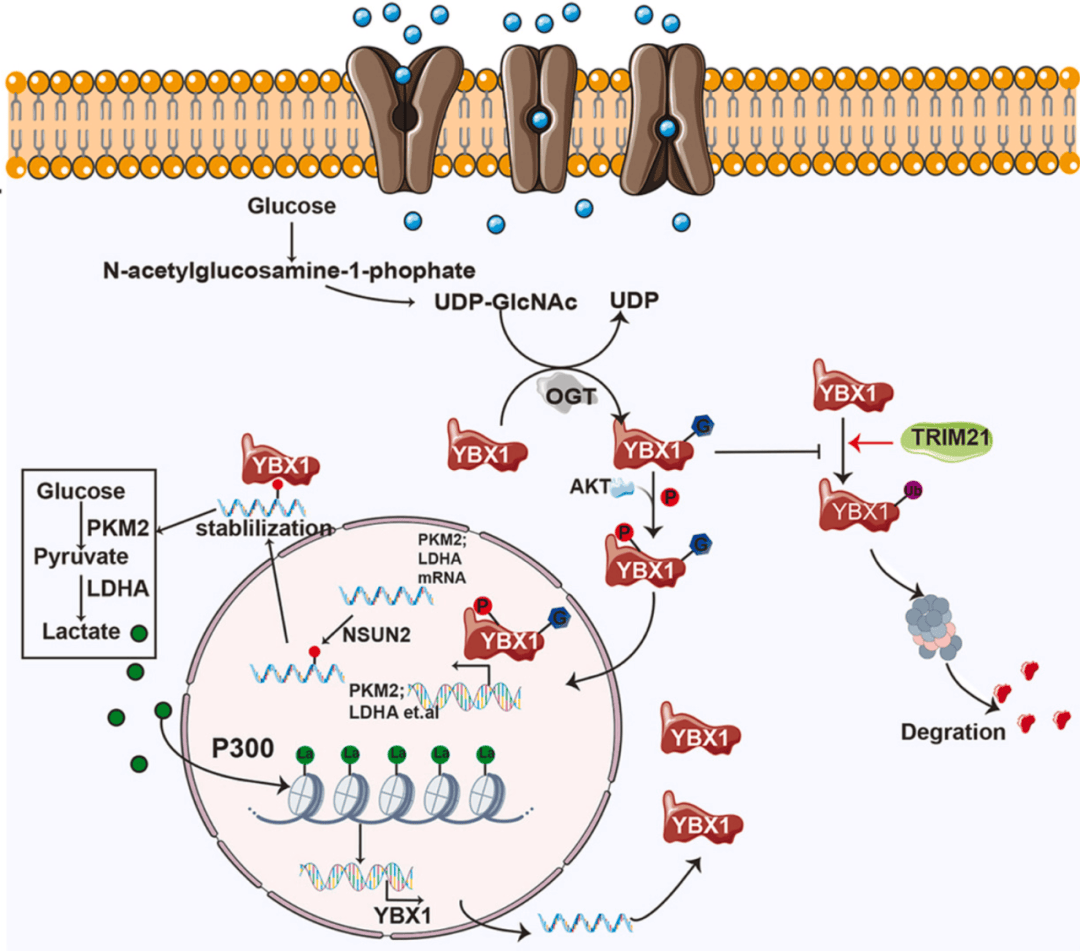 图7.Y糖酵解-表观遗传正反馈环机制图
图7.Y糖酵解-表观遗传正反馈环机制图
拜谱小结
本研究结合了单细胞转录组、空间转录组的数据,利用转录组、蛋白互作组、代谢组以及多种分子实验揭示了一个YBX1-糖酵解-H3K18la 的反馈回路,驱动HCC进展,并提示针对HCC代谢的潜在治疗策略。拜谱生物为该研究提供了转录组测序,蛋白互作组和靶向能量代谢组技术服务,拜谱生物建立了完善成熟的转录组学、蛋白组学、翻译后修饰组学、代谢组学以及多组学联合产品技术服务体系,助力发表高分文献,欢迎致电咨询!
参考文献
Ji Y, Xu Z, Tang L, Huang T, et,al.. O-GlcNAcylation of YBX1 drives a glycolysis-histone lactylation feedback loop in hepatocellular carcinoma. Cancer Lett. 2025 Oct 28;631:217957. doi: 10.1016/j.canlet.2025.217957. Epub 2025 Jul 26. PMID: 40721081.