

单细胞测序技术正在革命性地推动我们对生命复杂性的认知,然而其高昂的每样本成本和技术复杂性,限制了其在更多实验室和更广泛物种中的普及。尽管多重样本标记技术能有效“降本增效”,但现有的方法往往受限于抗体物种特异性、寡核苷酸修饰成本高昂或操作流程复杂。近日,南方海洋科学与工程广东实验室(广州)的陈凯教授团队在Journal of Genetics and Genomics上发表了一项创新性方法学研究,提出了一种名为HEATag的新型样本标记策略,为我们提供了一个低成本、跨物种、全平台兼容的全新解决方案。

期刊简介
Journal of Genetics and Genomics (JGG)是由中国科学院遗传与发育生物学研究所和中国遗传学会主办的国际学术期刊,致力于报道生命科学和医学遗传学领域的原创性研究成果。JGG 2024年度影响因子7.1,Scopus学术期刊评价指标CiteScore 9.9,位列JCR 2024年度GENETICS & HEREDITY领域Q1区(Top 10%),BIOCHEMISTRY & MOLECULAR BIOLOGY领域Q1区,位列中国科学院期刊分区生物学大类1区(Top期刊),遗传学和生化与分子生物学小类双1区。
BIOPROFILE
什么是HEATag
巧妙的“二合一”设计
HEATag是由凝集素和HUH内切酶构成的融合蛋白
「定位器」模块 - 凝集素
能够识别细胞膜上广泛存在且高度保守的糖基化修饰(如GlcNAc和Neu5Ac)。
「连接器」模块 - HUH内切酶
可以序列特异性地与普通的、无需化学修饰的单链DNA(ssDNA)索引条形码进行共价连接。
“1+1>2”的效果:将两者融合,得到的HEATag蛋白既能通过凝集素牢牢锚定在细胞膜上,又能通过HUH蛋白携带特定的DNA条形码进行样本标记与溯源。
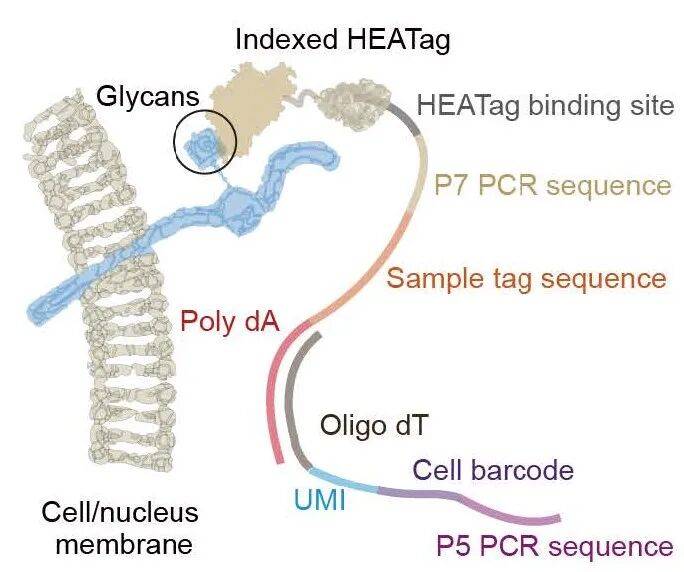 Fig1: HEATag多重标记原理示意图
Fig1: HEATag多重标记原理示意图
BIOPROFILE
实战检验
HEATag到底有多能打?
可以在不同条件下,实现哺乳动物细胞系单细胞混样测序
实验室里的设计再精妙,也要经过真实样本的 “实战考验” 才算数。研究团队为 HEATag 设置了多轮 “压力测试”,从细胞系到细胞核,从常温到低温,从新鲜样本到固定样本,全方位验证它的稳定性和可靠性。
第一轮测试针对哺乳动物细胞系:研究人员选择了来自人、鼠、仓鼠三个物种的四种细胞(HEK293T、K562、MEF、CHO),在室温下用 HEATag 标记后混合测序。最终回收的 11447 个细胞中,85.66% 都能通过 HEATag 条形码准确匹配到原物种,样本间交叉污染极少,UMAP 聚类分析更是直接证明,HEATag 条形码与物种特异性基因组特征高度一致。
接着,测试条件进一步升级:研究人员尝试在 4℃下标记新鲜细胞、在室温下标记甲醇固定细胞,甚至直接标记细胞核。结果依然亮眼:所有条件下,样本标签与物种信息均具有很好的相关性,拆分准确率超 95%。即便甲醇固定会导致轻微的转录本交叉污染,细胞核制备会有少量 RNA 流失,细胞类型的注释结果依然与新鲜样本保持一致,证明 HEATag 可以标记不同处理条件下的实验样本。
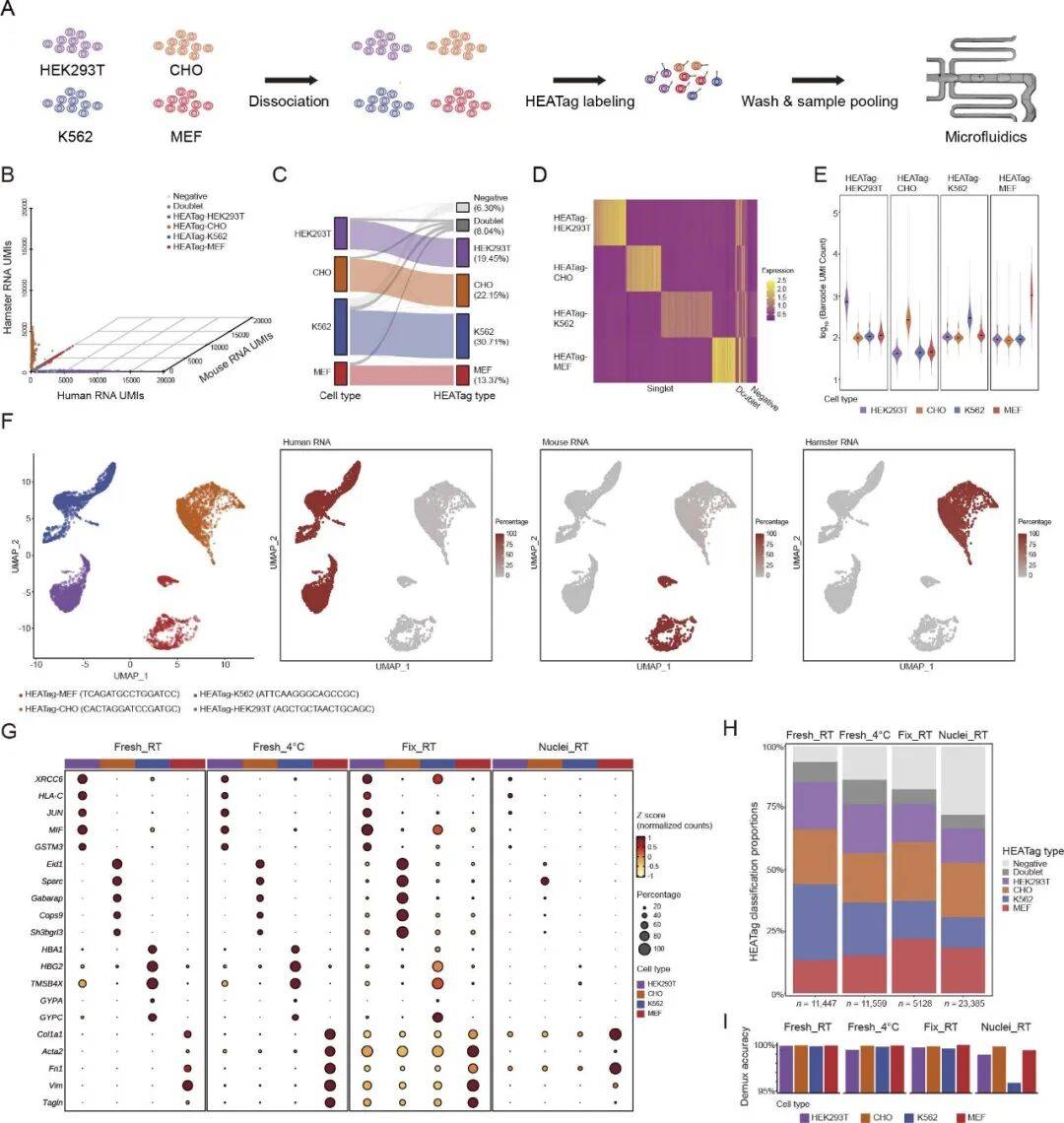 Fig2: HEATag 可在不同条件下完成单细胞转录组混样分析
Fig2: HEATag 可在不同条件下完成单细胞转录组混样分析
能够标记哺乳动物和海洋无脊椎动物的原代细胞
如果说细胞系测试是 “基础题”,那组织样本就是 “附加题”, 这些样本往往因细胞类型复杂、环境适应性特殊,成为标记技术的 “难点”,而 HEATag 恰恰在这些 “难点” 上展现了优势。
研究团队选择了大鼠和小鼠的睾丸组织,这类样本包含精原干细胞、精母细胞、精子细胞等多种类型,对标记一致性的要求极高。实验中,两种动物的睾丸用特异性 HEATag 条形码标记后混合测序,最终获得的 14663 个细胞不仅能被准确区分,所有主要细胞类型的聚类结果都清晰可辨。
更令人惊喜的是HEATag对海洋生物的适配性。HEATag能在海水的等渗溶液中标记新鲜的海洋动物细胞(如海月水母、大西洋海刺水母)。研究人员用人工海水稀释的HEATag 标记了水母和珊瑚的组织细胞后在 BD Rhapsody 平台测序,最终回收的 6452 个细胞中,HEATag 条形码与物种转录组具有较高一致性,没有出现因高盐环境导致的 “标记失效”。后续对甲醇固定的海洋生物细胞测试结果显示,HEATag 在固定样本中的拆分效果优于新鲜样本。
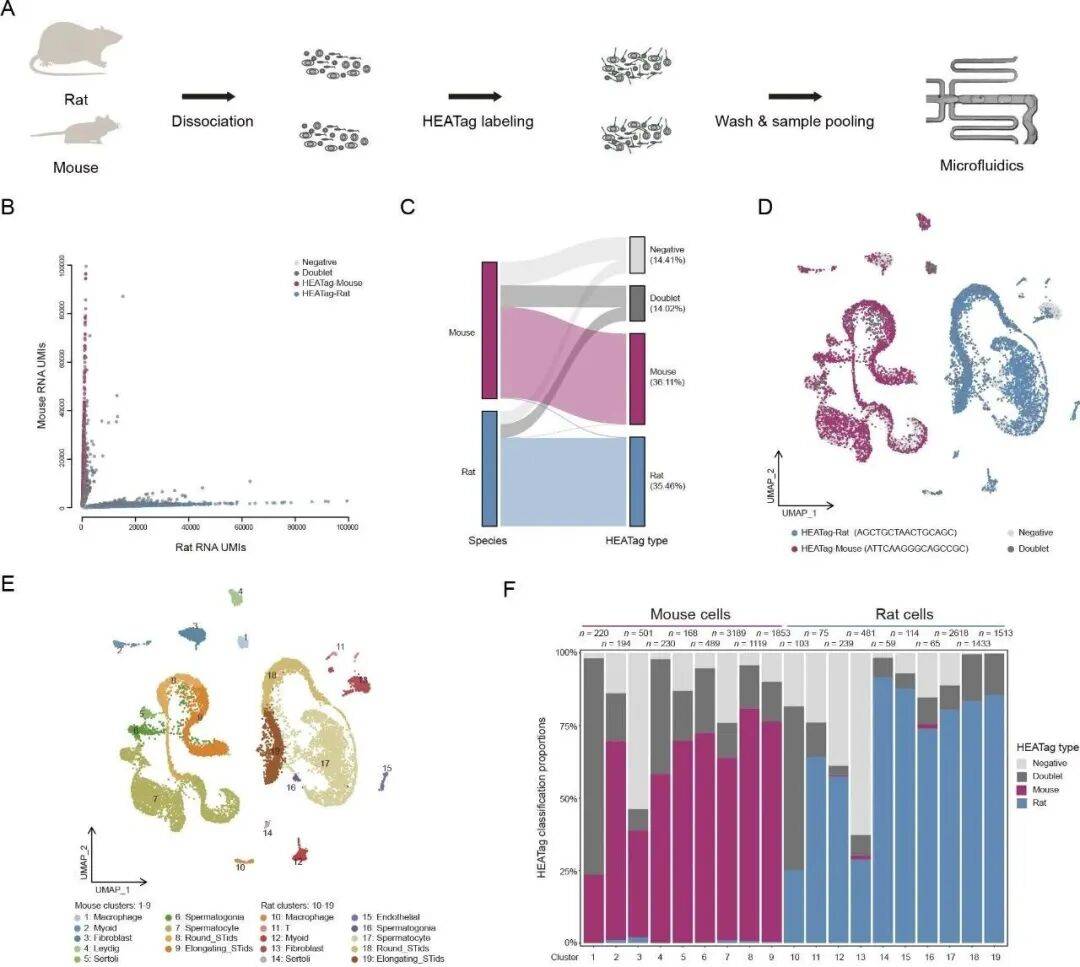 Fig3: HEATag 可实现哺乳动物组织样本多重 scRNA-seq 分析
Fig3: HEATag 可实现哺乳动物组织样本多重 scRNA-seq 分析
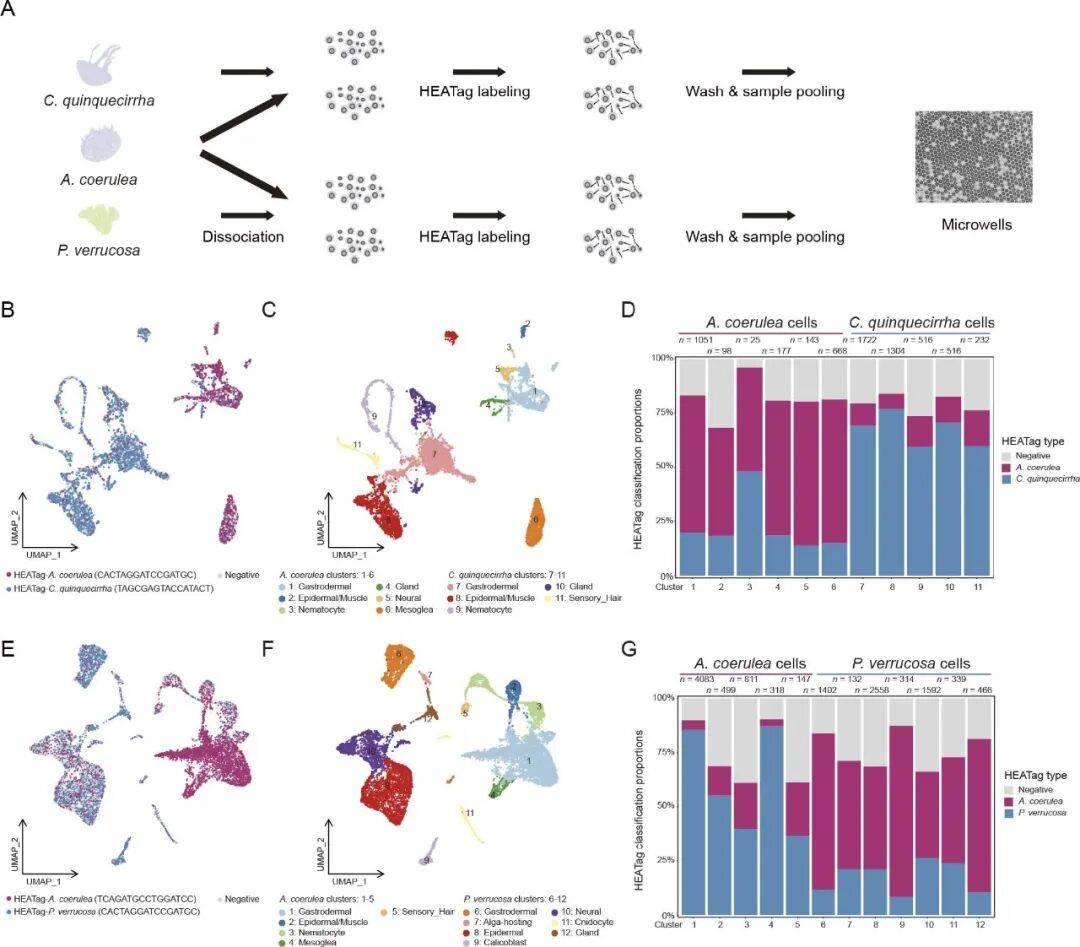 Fig4: HEATag可实现新鲜海洋无脊椎动物多重 scRNA-seq 分析
Fig4: HEATag可实现新鲜海洋无脊椎动物多重 scRNA-seq 分析
HEATag与细胞的结合不会引起转录组的显著改变
对样本标记技术来说,“不影响样本本身的 RNA 特征” 是底线。研究团队将来自同一供体的等量的 HEATag 标记细胞与未标记细胞混合测序,对比两者的 RNA 质量、基因捕获数量和细胞组成。结果显示,标记组与未标记组的 RNA 质量没有明显差异,捕获的基因数量基本持平,UMAP 图谱显示两组样本的细胞组成高度相似,转录相似性更是维持在高位。无论是细胞簇的注释结果,还是不同细胞类型的基因回收数量,两组都几乎一致,没有出现 “标记导致的基因表达异常”。这意味着,HEATag在完成标记任务的同时,不会对后续的转录组分析造成干扰,保证了研究数据的真实性。
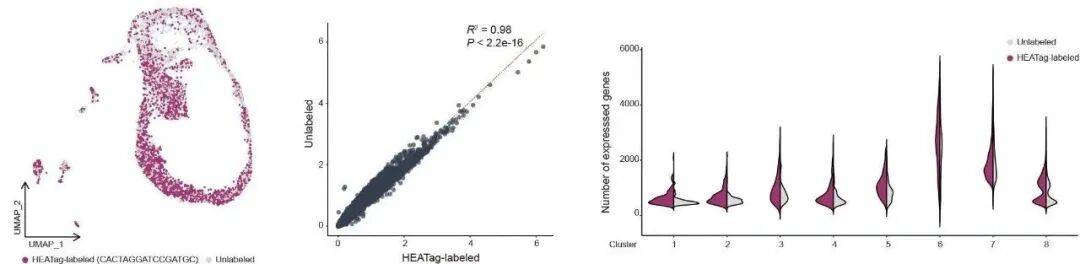 Fig5: HEATag不会影响样本的 RNA 表达模式
Fig5: HEATag不会影响样本的 RNA 表达模式
BIOPROFILE
未来可期
HEATag 能为单细胞研究带来什么?
HEATag 的价值,远不止于 “解决标记问题”,它的灵活性和普适性,正在为单细胞研究打开更多可能性
从应用场景来看
HEATag 能覆盖从 “简单比较分析”(如癌组织与正常组织、药物处理与对照)到 “大规模研究”(如组织细胞图谱绘制、高通量筛选)的全范围需求。随着 PIP-seq、Stereo-cell 等新型可扩展技术的发展,HEATag 还能进一步提升单细胞研究的通量,助力科研团队开展更大规模的项目。
从跨领域潜力来看
HEATag 不仅适用于转录组学,还能与表观基因组学、蛋白质组学、空间组学等技术结合,通过定制索引和寡核苷酸序列,HEATag 可以轻松融入不同的组学流程,不影响信号捕获深度。同时,基于HEATag还可以发展单细胞糖组学研究技术。
BIOPROFILE
合作动态
拜谱生物与陈凯教授达成初步合作意向
值得关注的是,在 HEATag 技术展现出巨大应用潜力的背景下,拜谱生物已与南方海洋科学与工程广东实验室(广州)陈凯教授达成初步合作意向。双方计划围绕 HEATag 技术的产业化落地、科研转化等方向展开深度协作,推动这一低成本、跨物种的单细胞标记技术更快应用于实际科研场景,为更多实验室提供高效、经济的单细胞研究工具,助力科研工作者在细胞生物学、海洋生物学、疾病机制等领域取得更多突破