

溃疡性结肠炎(UC)是一种以结肠黏膜溃疡和慢性炎症为特征的疾病。传统的免疫抑制和抗炎治疗对部分患者效果不佳,因为它们不能直接促进黏膜愈合。黏膜愈合是治疗UC的关键目标,与降低并发症、住院风险和手术干预率密切相关。研究发现,UC发病率存在性别差异,男性高于女性,且症状与雌激素水平相关。雌激素受体β(ERβ)在结肠组织中占主要地位,其激活可改善动物模型中的结肠炎,但其在黏膜愈合中具体的作用机制尚不明确。
2025年1月中国药科大学戴岳教授团队在Acta Pharmaceutica Sinica B杂志上发表题为“Facilitation of mucosal healing by estrogen receptor β in ulcerative colitis through suppression of branched-chain amino acid transport and subsequent triggering of autophagy in colonic epithelial cells”文章。研究利用转录组学、代谢组学等技术,首次证实结肠上皮细胞中ERβ激活程度与UC患者黏膜愈合呈正相关,ERβ激活可通过抑制支链氨基酸转运增强自噬,加速结肠上皮细胞迁移,从而促进黏膜愈合。此外,ERβ激动剂与一线UC治疗药物5-氨基水杨酸(5-ASA)联合使用,可产生协同抗结肠炎效果,为UC治疗提供新的策略。拜谱生物为该研究提供了转录组学、代谢组学技术服务。

英文标题:Facilitation of mucosal healing by estrogen receptor β in ulcerative colitis through suppression of branched-chain amino acid transport and subsequent triggering of autophagy in colonic epithelial cells
中文标题:雌激素受体β通过抑制支链氨基酸运输并随后触发结肠上皮细胞自噬促进溃疡性结肠炎粘膜愈合
期刊:Acta Pharmaceutica Sinica B
影响因子:14.7
发表时间:2025年1月
客户单位:中国药科大学
研究材料:人、小鼠结肠组织
拜谱提供技术:转录组学、代谢组学
研究思路:
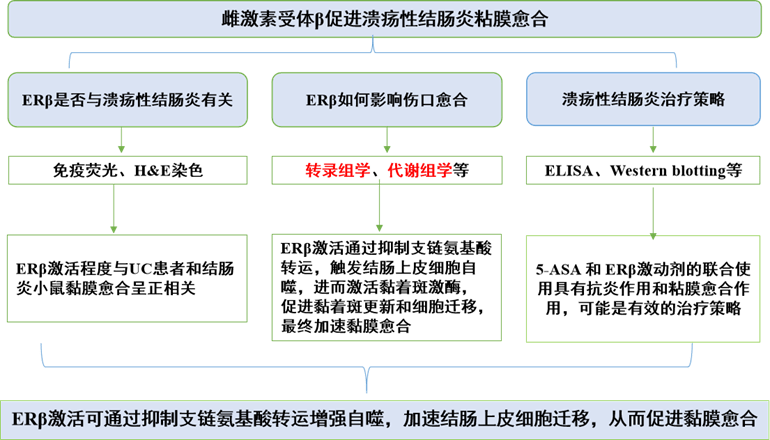
研究结果
ERβ激活程度与UC患者黏膜愈合呈正相关
研究发现UC患者中,ESR2(ERβ编码基因)和Caveolin-1(ERβ靶基因)的表达与黏膜愈合相关因子(TFF3、EGF和occludin)的表达呈正相关(图1 A-D)。DSS诱导的结肠炎小鼠中,ESR2和Caveolin-1的表达也显著降低,与UC患者的结果一致(图1 H-K)。结果表明,ERβ激活与UC患者和结肠炎小鼠的黏膜愈合密切相关,提示激活ERb可能促进UC患者的黏膜愈合。
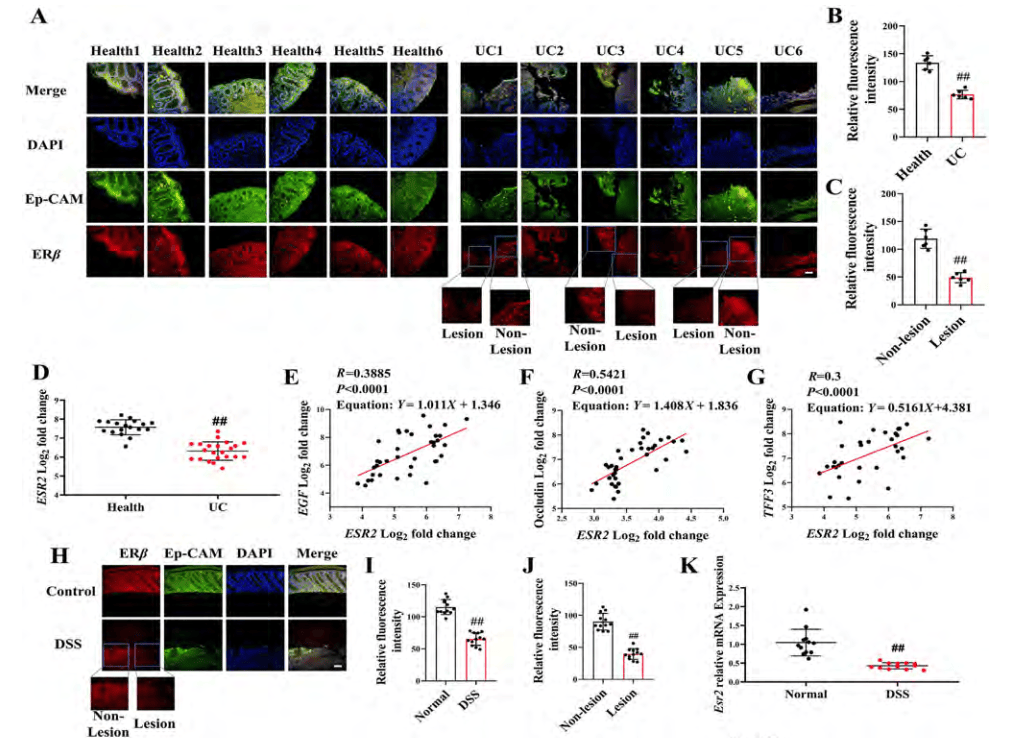 图1. 结肠上皮细胞中ERβ表达与UC患者和结肠炎小鼠粘膜愈合之间的相关性
图1. 结肠上皮细胞中ERβ表达与UC患者和结肠炎小鼠粘膜愈合之间的相关性
(图源:Yilei Guo, et al.; Acta Pharmaceutica Sinica B, 2024)
ERβ激活可促进UC小鼠的结肠黏膜愈合
在DSS诱导的结肠炎小鼠模型中,给予ERb激动剂DPN和LIQ可以有效降低结肠缩短、疾病活动指数(DAI)评分和病理评分(图2 A-E)。DPN和LIQ还能显著降低黏膜损伤指标,包括溃疡评分和FITC-dextran肠通透性,并加速溃疡伤口愈合(图2 F-H)。DPN和LIQ显著上调了黏膜愈合因子的表达,同时仅对髓过氧化物酶(MPO)活性和促炎细胞因子的表达产生轻微抑制作用(图2 I、J)。
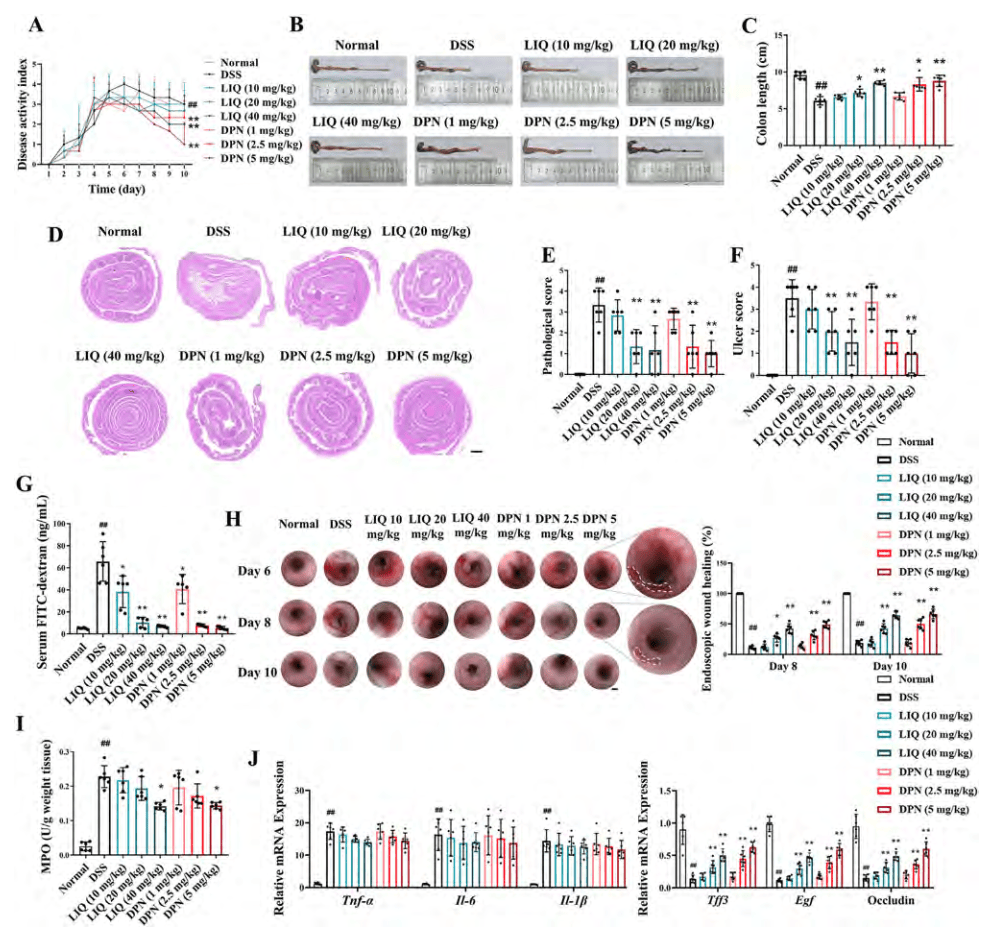 图2. ERβ激活促进了DSS诱导的结肠炎小鼠的结肠粘膜愈合
图2. ERβ激活促进了DSS诱导的结肠炎小鼠的结肠粘膜愈合
(图源:Yilei Guo, et al.; Acta Pharmaceutica Sinica B, 2024)
结肠活检受伤小鼠体内实验发现,DPN和LIQ显著促进了小鼠黏膜活检伤口的愈合(图3 C、D)。Ep-CAM染色进一步证实,LIQ和DPN显著缩短了活检伤口横截面的长度(图3 E、F)。结果表明,ERb激活可以直接促进UC小鼠的结肠黏膜愈合。
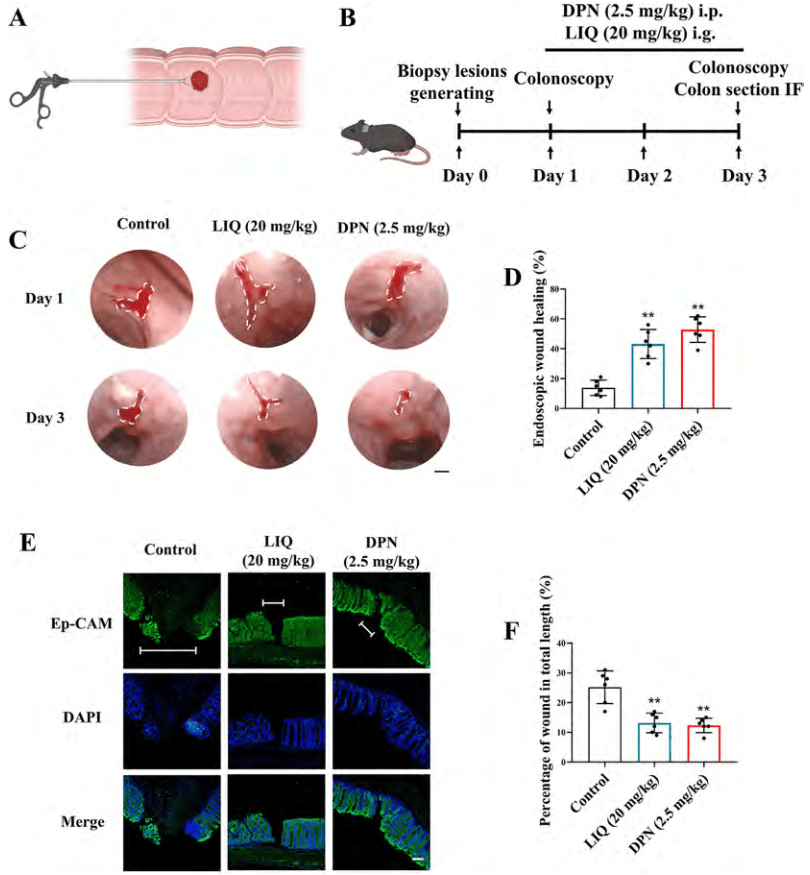 图3.ERβ激活促进了活检诱导的结肠损伤小鼠的结肠粘膜愈合
图3.ERβ激活促进了活检诱导的结肠损伤小鼠的结肠粘膜愈合
(图源:Yilei Guo, et al.; Acta Pharmaceutica Sinica B, 2024)
ERβ激活通过加速黏着斑转换促进结肠上皮细胞迁移和伤口愈合
为了研究ERβ激活对结肠上皮细胞伤口愈合的体外效应,进行了划痕实验。结果显示,DPN和LIQ显著促进了NCM460和HT-29细胞的伤口愈合(图4 A、B),通过增强细胞迁移而非增殖来促进伤口愈合(图4 C-F)。DPN显著缩短了焦点粘附的组装和解聚时间,并增强了FAK的激活(图4 G-J)。
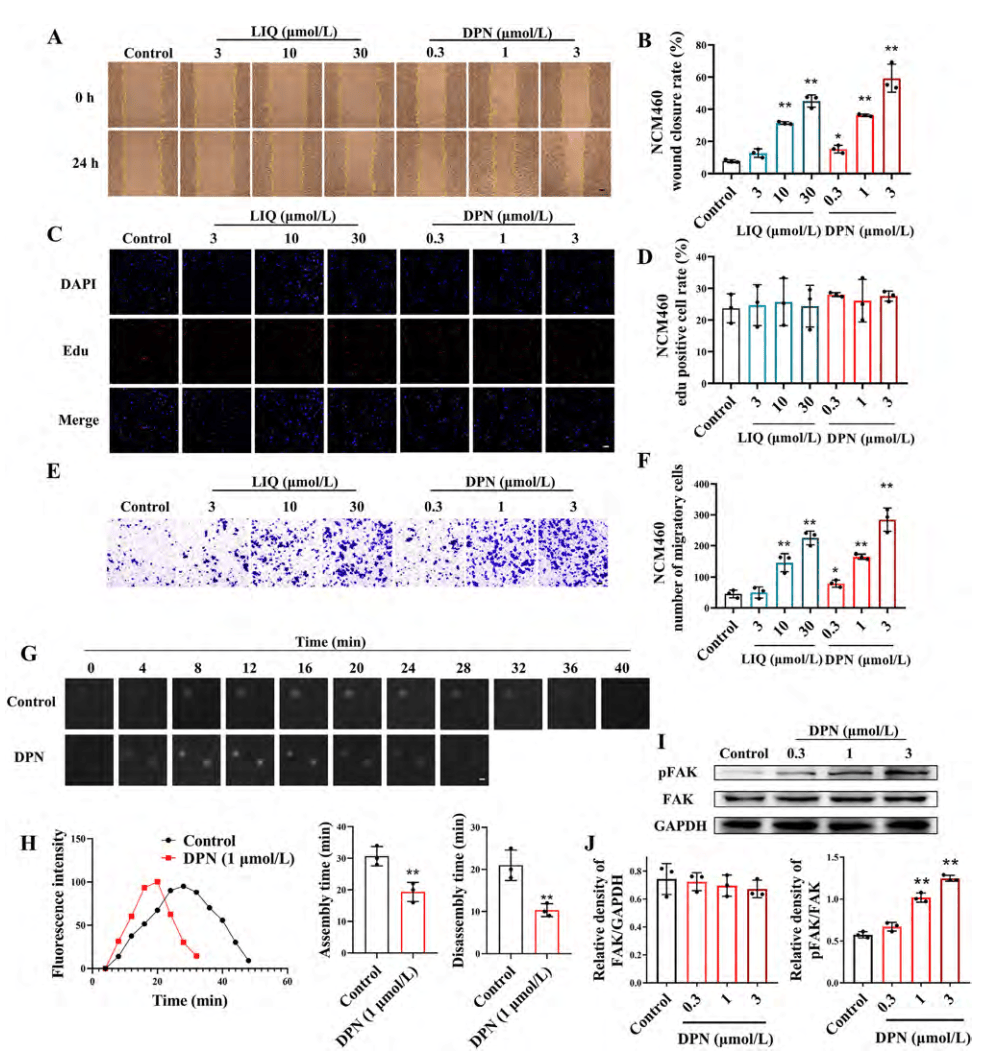 图4. ERβ激活促进结肠上皮细胞的粘附转换、细胞迁移和创面愈合
图4. ERβ激活促进结肠上皮细胞的粘附转换、细胞迁移和创面愈合
(图源:Yilei Guo, et al.; Acta Pharmaceutica Sinica B, 2024)
使用FAK特异性抑制剂PF-573228或siFAK可以减弱DPN对焦点粘附周转、细胞迁移及伤口愈合的促进作用(图5 A-F)。综上所述,ERβ激活通过加速FAK介导的焦点粘附周转来促进结肠上皮细胞的迁移和伤口愈合,而不是通过促进细胞增殖。这一机制为开发基于ERβ的新疗法提供了重要的理论依据。
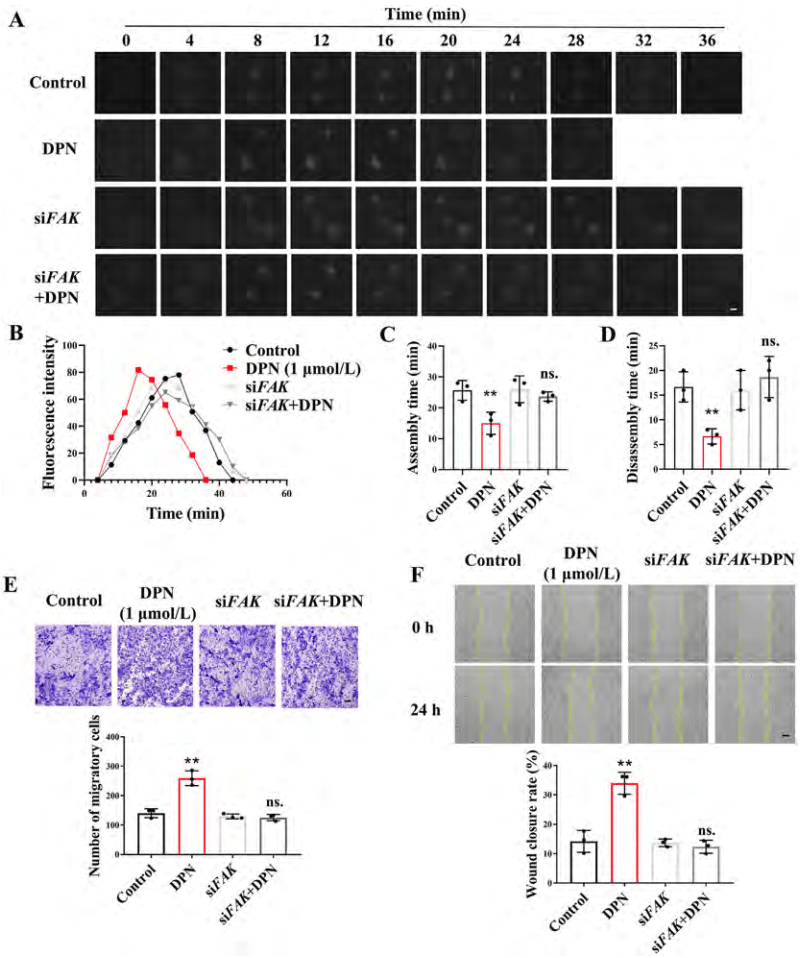 图5. ERβ活化可通过加速局灶粘附周转促进结肠上皮细胞迁移和伤口愈合
图5. ERβ活化可通过加速局灶粘附周转促进结肠上皮细胞迁移和伤口愈合
(图源:Yilei Guo, et al.; Acta Pharmaceutica Sinica B, 2024)
ERβ激活通过增强自噬加速结肠上皮细胞黏着斑转换
为了进一步探究ERβ激活如何加速黏着斑周转,通过转录组学分析比较了DPN处理和未处理的NCM460细胞的基因表达谱。RNA测序数据显示,DPN处理的细胞中自噬相关基因显著上调(图6 A-C)。DPN还促进了LC3Ⅰ向LC3Ⅱ的转化,并加速了SQSTM1的降解(图6 D)。透射电子显微镜和共聚焦显微镜显示,DPN处理的细胞中自噬体和自溶酶体数量增加(图6 E、F)。接下来,通过细胞实验证明明ERβ主要通过自噬体形成刺激FAK(图6 G-H)。免疫共沉淀实验显示,DPN处理显著抑制了FAK与FIP200之间的相互作用(图6I)。共定位染色图像显示,DPN处理后,标记FAK的焦点粘附和标记FIP200的自噬体并未共定位(图6J)。综上所述,ERβ激活通过促进自噬体形成来加速焦点粘附周转和伤口愈合。
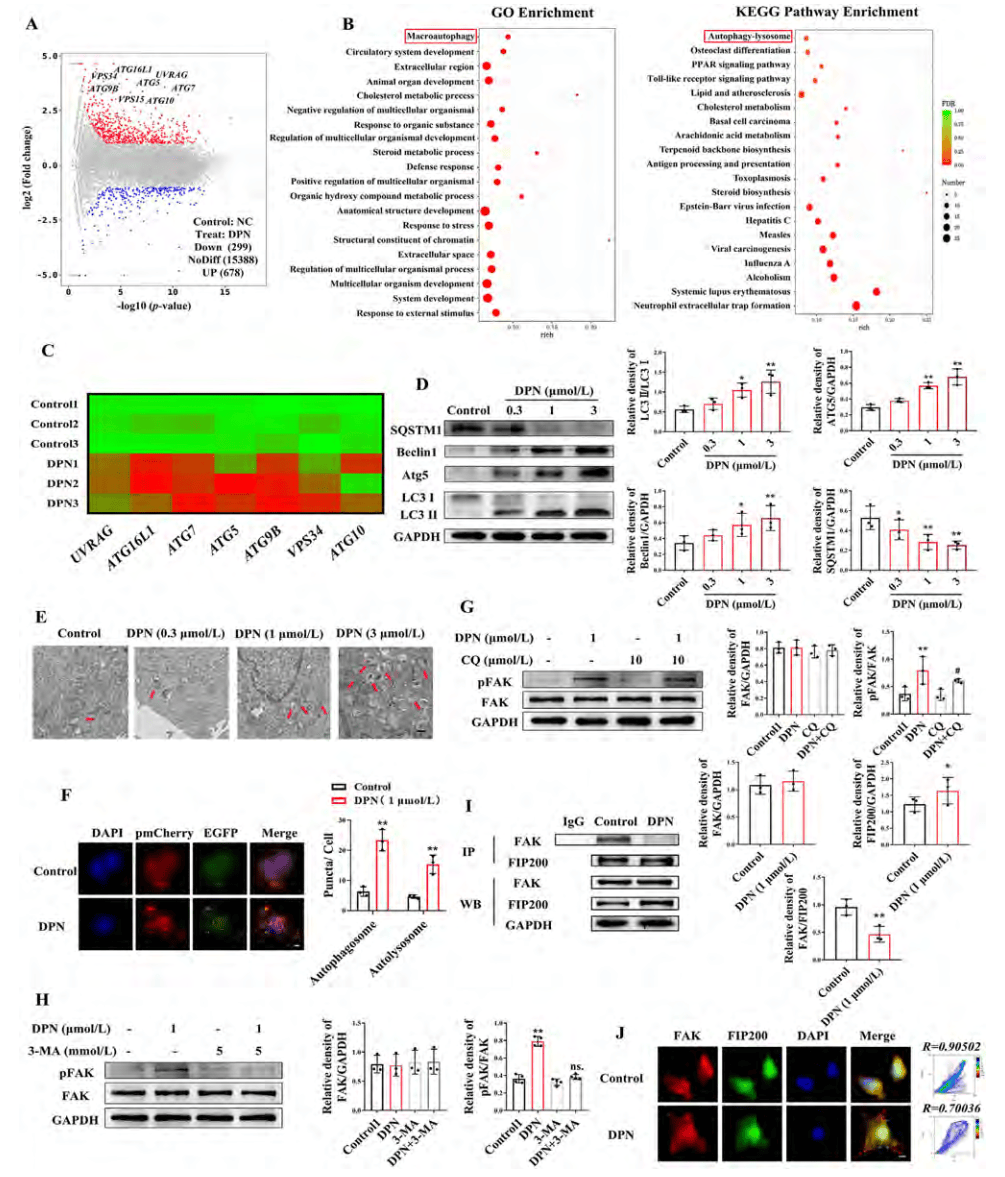 图6 ERβ激活增强了结肠上皮细胞中的自噬,并通过促进自噬体形成来激活FAK
图6 ERβ激活增强了结肠上皮细胞中的自噬,并通过促进自噬体形成来激活FAK
(图源:Yilei Guo, et al.; Acta Pharmaceutica Sinica B, 2024)
ERβ激活通过抑制支链氨基酸转运促进结肠上皮细胞自噬
通过代谢组学分析DPN处理的NCM460细胞和对照组的代谢物,发现DPN处理后,氨基酸和短肽类代谢物变化最为显著。KEGG分析显示,与氨基酸代谢和跨膜运输相关的代谢物显著富集,特别是支链氨基酸(缬氨酸、亮氨酸、异亮氨酸)显著减少(图7 A-D)。进一步研究发现,DPN处理导致LAT1表达下降,ERβ激活后可能通过结合LAT1基因的沉默子区域抑制其表达(图7 E-G)。此外,通过共转染LAT1-质粒发现,ERβ激活通过抑制氨基酸运输抑制mTOR激活,从而诱导自噬(图7 H)。综合代谢组和转录组数据分析,自噬、支链氨基酸运输和mTOR信号通路显著富集,进一步支持了研究结论。综上,ERβ激活通过抑制LAT1表达、支链氨基酸运输和mTOR激活,最终诱导结肠上皮细胞自噬。
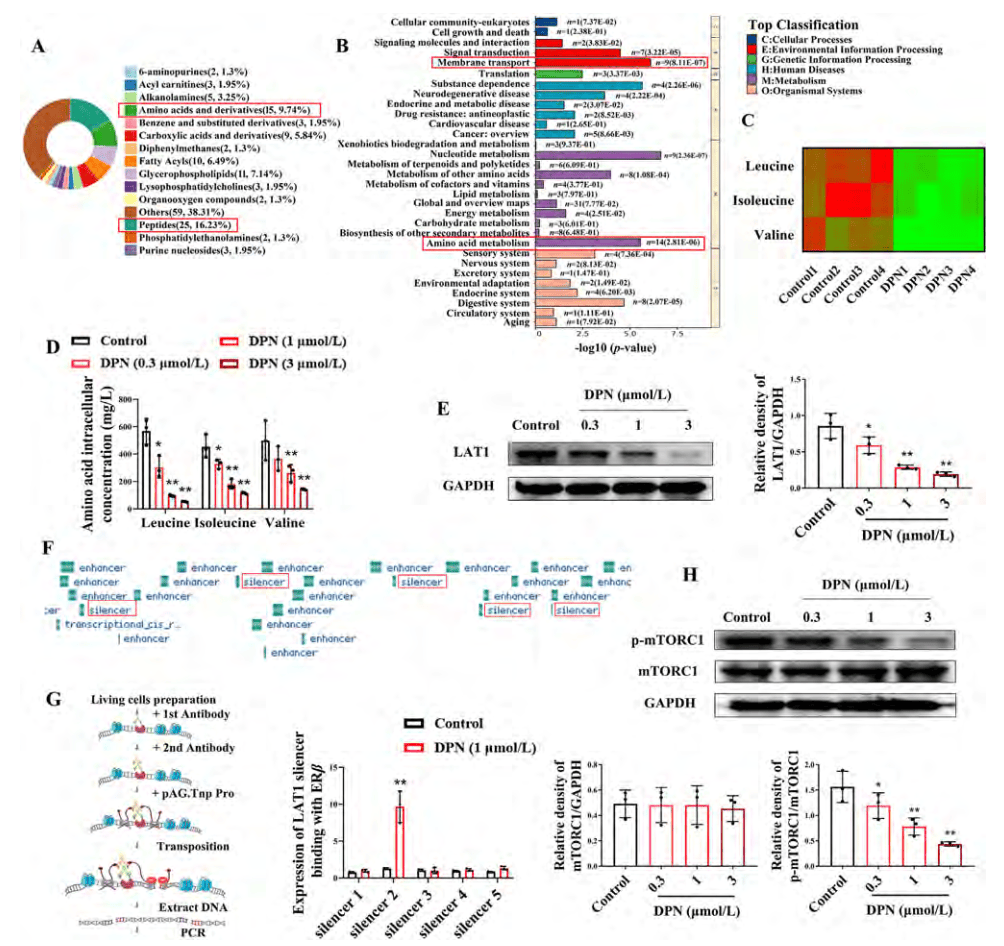 图7 .ERβ激活通过下调LAT1的表达来抑制结肠上皮细胞中的支链氨基酸转运
图7 .ERβ激活通过下调LAT1的表达来抑制结肠上皮细胞中的支链氨基酸转运
(图源:Yilei Guo, et al.; Acta Pharmaceutica Sinica B, 2024)
ERβ介导结肠炎小鼠伤口愈合
研究通过ERβ基因敲除(ERβ−/−)小鼠模型,探讨了ERβ缺失对结肠炎小鼠黏膜愈合的影响及其机制。结果表明,ERβ激动剂DPN可促进黏膜愈合,但此效果在ERβ缺失小鼠中消失。DPN和5-氨基水杨酸(5-ASA)联合治疗结肠炎小鼠,结果显示两者协同作用显著,降低炎症评分,促进黏膜愈合,同时上调愈合相关因子,下调炎症因子(图8)。
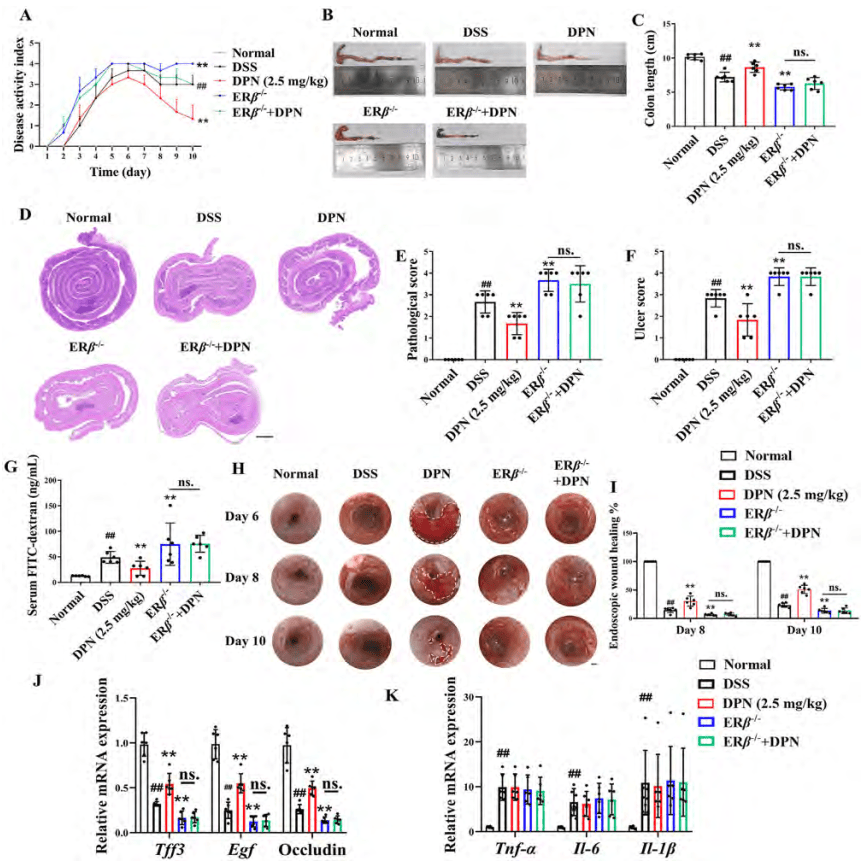 图8 .ERβ介导结肠炎小鼠伤口愈合
图8 .ERβ介导结肠炎小鼠伤口愈合
(图源:Yilei Guo, et al.; Acta Pharmaceutica Sinica B, 2024)
文章小结
研究发现,ERβ激活程度与UC患者的黏膜愈合呈正相关。在DSS诱导的小鼠结肠炎模型中,ERβ激活通过抑制支链氨基酸转运,触发结肠上皮细胞自噬,进而激活黏着斑激酶(FAK),促进黏着斑更新和细胞迁移,最终加速黏膜愈合。此外,ERβ激动剂与5-ASA联合使用,显著增强了对结肠炎的治疗效果(图9)。这些结果表明,ERβ在UC治疗中具有重要的潜在应用价值。
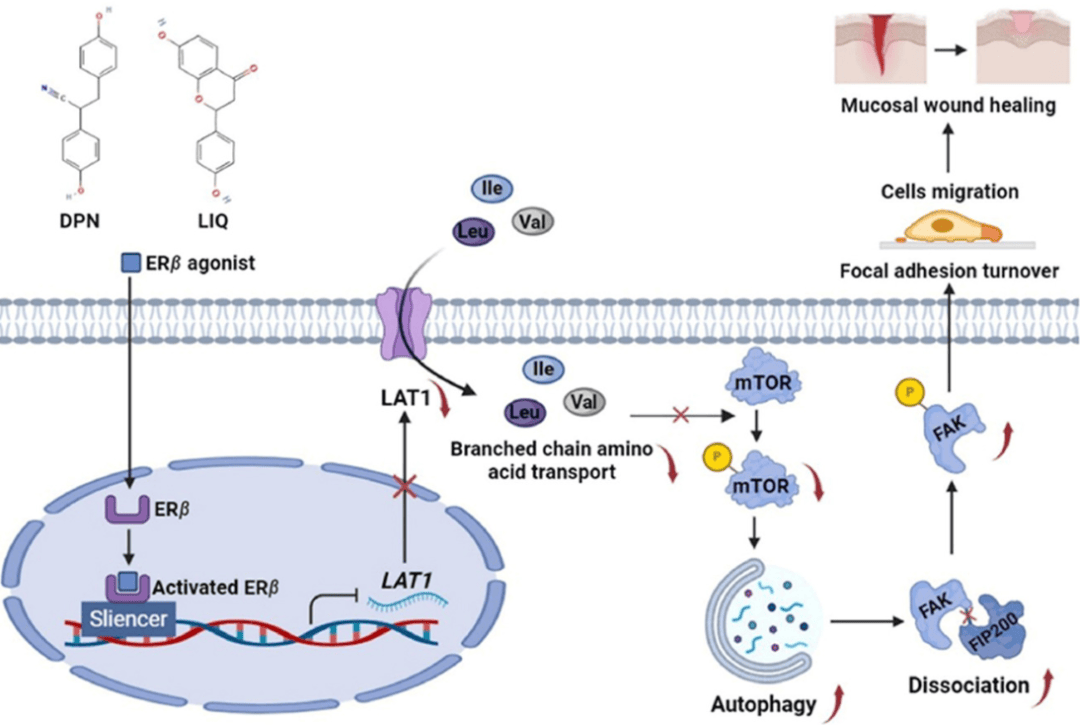 图9 .雌激素受体β促进溃疡性结肠炎粘膜愈合
图9 .雌激素受体β促进溃疡性结肠炎粘膜愈合
(图源:Yilei Guo, et al.; Acta Pharmaceutica Sinica B, 2024)
拜谱小结
研究采用转录组学、代谢组学等研究方法。揭示了ERβ在UC中促进结肠黏膜愈合的作用机制。这一发现不仅为UC治疗提供了新的思路,还展示了代谢组学和转录组学在疾病研究中的强大应用潜力。拜谱生物作为一家国内领先的多组学服务公司,可提供完善成熟的蛋白质组学、修饰蛋白质组学、代谢组学、转录组学等多组学产品技术服务体系,整合多组学数据进行深入挖掘分析,全面解析机制机理等,助力高分文章发表。
参考文献:
Guo Y, Zhu Y, Zhang J, et al. Facilitation of mucosal healing by estrogen receptor β in ulcerative colitis through suppression of branched-chain amino acid transport and subsequent triggering of autophagy in colonic epithelial cells[J]. Acta Pharmaceutica Sinica B, 2024.