

在肿瘤免疫治疗与营养代谢交叉领域,维生素C(vitC)的抗癌机制长期存在争议。传统研究聚焦于vitC通过产生活性氧(ROS)或作为TET酶的辅助因子发挥表观遗传调控作用,但这些机制无法完全解释高剂量vitC在临床中表现出的免疫增强效应。关键问题在于:vitC是否通过未知的直接分子机制调控免疫信号通路?
2025年2月28日上海交通大学瑞金医院何吓俤在Cell杂志(IF45.5)上发表了题为“Lysine vitcylation is a vitamin C-derived protein modification that enhances STAT1-mediated immune response”的研究文章,本研究首次发现vitC可直接修饰赖氨酸残基,形成新型翻译后修饰“赖氨酸vitcylation”,并揭示其通过稳定STAT1磷酸化增强干扰素信号通路,最终激活抗肿瘤免疫反应。这一发现不仅填补了vitC作用机制的空白,更为联合免疫治疗提供了全新策略。
01、从化学修饰到细胞验证:vitcylation的发现
研究团队在无酶体系中,将vitC与赖氨酸肽段共孵育后,质谱检测到一个175 Da的特征质量偏移——这正是vitC分子通过内酯环开环反应与赖氨酸ε-氨基共价结合的标志,形成一种新的修饰形式——vitcyl-lysine(vitcylation)(图1B)。这一修饰过程依赖于vitC的剂量、pH值和氨基酸序列(图1A)。通过质谱分析,研究团队确认了vitcylation的存在,并进一步验证了其在细胞内的广泛存在(图1B, 1C),同位素标记实验(¹³C-vitC)锁定修饰位点,而将赖氨酸替换为精氨酸或丙氨酸则完全阻断了这一过程(图1D)。值得注意的是,vitcylation在生理pH条件下表现出较高的修饰效率,尤其是在pH 9-10范围内。
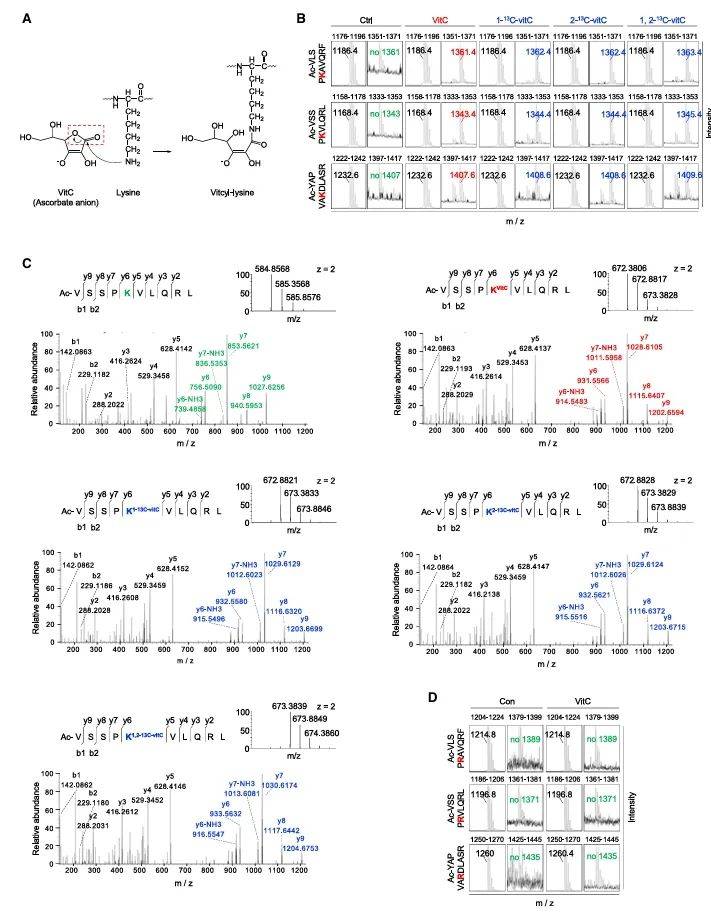 图1 在无细胞系统中,维生素C修饰肽段的赖氨酸残基形成vitcyl-lysine
图1 在无细胞系统中,维生素C修饰肽段的赖氨酸残基形成vitcyl-lysine
(图源:He, et al., Cell, 2025)
当研究转向细胞层面,质谱从人源(Cal-51)和小鼠(E0771)肿瘤细胞中分别鉴定出553和1405个vitcyl化蛋白,涵盖核内调控因子、线粒体代谢酶等多类分子(图2A-B)。有趣的是,线粒体因碱性微环境(pH 7.7-8.2)成为vitcylation的“热点区”,修饰水平显著高于胞质(图2L)。这种pH依赖性提示,vitC在特定亚细胞区室中可能扮演更活跃的“修饰工程师”角色。
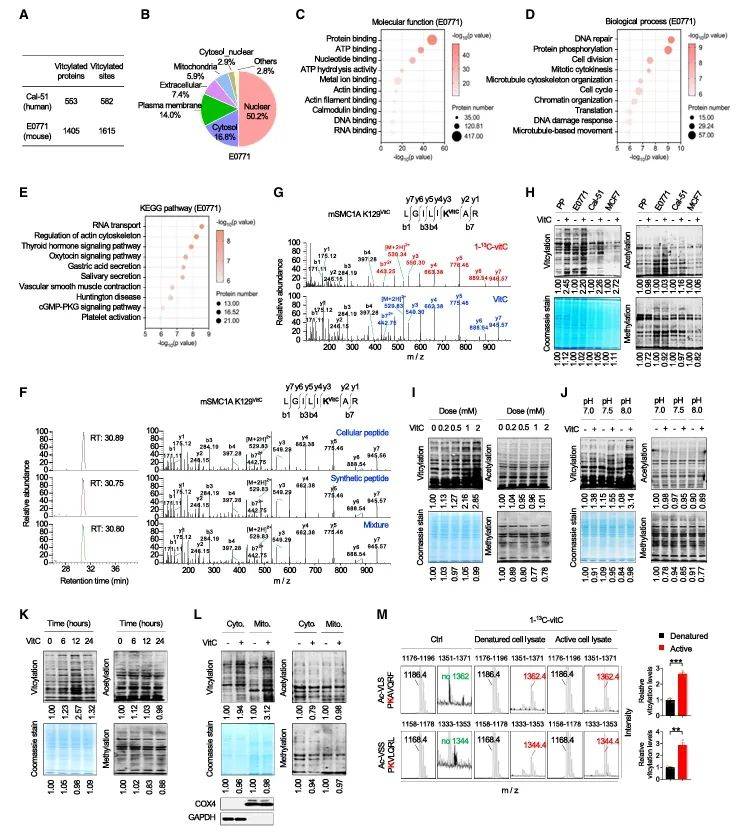 图2 维生素C诱导细胞蛋白质赖氨酸vitcylation
图2 维生素C诱导细胞蛋白质赖氨酸vitcylation
(图源:He, et al., Cell, 2025)
02、STAT1:vitcylation调控免疫的枢纽靶点
接下来,研究团队探讨了vitcylation在细胞内的功能。通过对肿瘤细胞进行vitC处理,作者发现vitC处理显著上调干扰素(IFN)通路基因(图3A, 3B),vitcylation显著增强了STAT1的磷酸化水平(图3E, 3F)。STAT1是干扰素(IFN)信号通路中的关键转录因子,其磷酸化水平直接影响免疫反应的强度。质谱数据锁定了STAT1第298位赖氨酸(K298),一个进化保守且暴露于蛋白表面的关键位点。当vitC修饰K298后,STAT1的磷酸化命运被彻底改写:Y701位点磷酸化(pSTAT1)水平显著升高(图3E, 3F),并促进其核转位(图3J)。
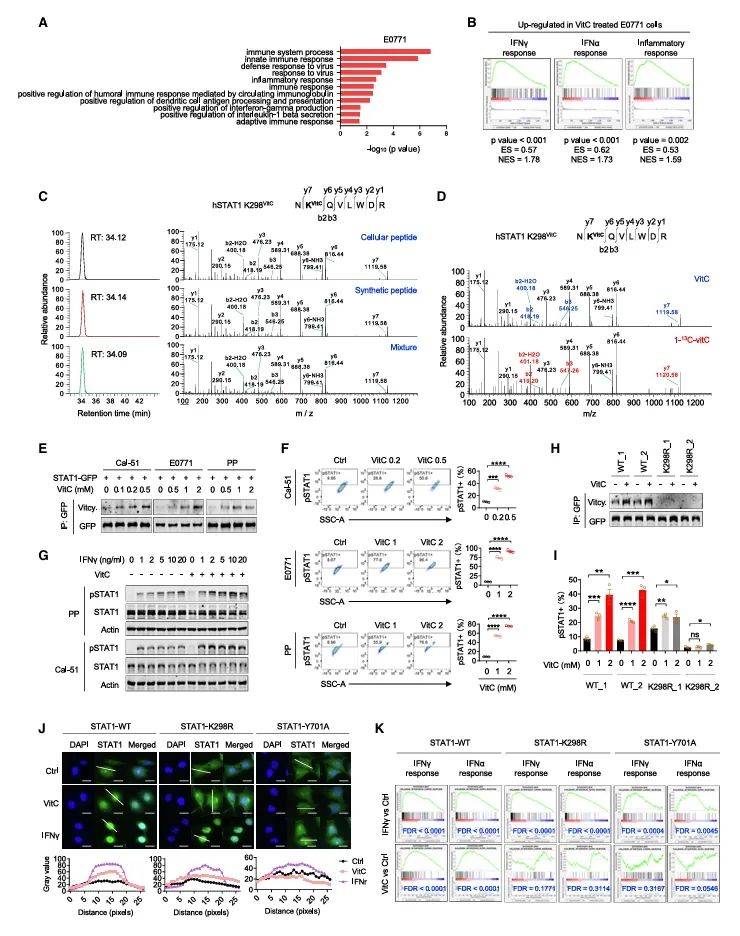 图3 STAT1 K298的vitcylation调节STAT1的磷酸化和激活
图3 STAT1 K298的vitcylation调节STAT1的磷酸化和激活
(图源:He, et al., Cell, 2025)
机制上,vitcylation通过抑制STAT1与T细胞蛋白酪氨酸磷酸酶(TCPTP)的相互作用,阻止了STAT1的去磷酸化,从而增强了其活性(图4B, 4C)。分子动力学模拟显示,K298修饰或慢性黏膜皮肤念珠菌病相关突变(K298N)均会瓦解STAT1反平行二聚体的盐桥网络(图4G-H),迫使磷酸化STAT1以活性构象持续传递信号。这一机制在多种肿瘤细胞系中得到了验证,表明vitcylation在STAT1信号通路调控中具有普遍性。
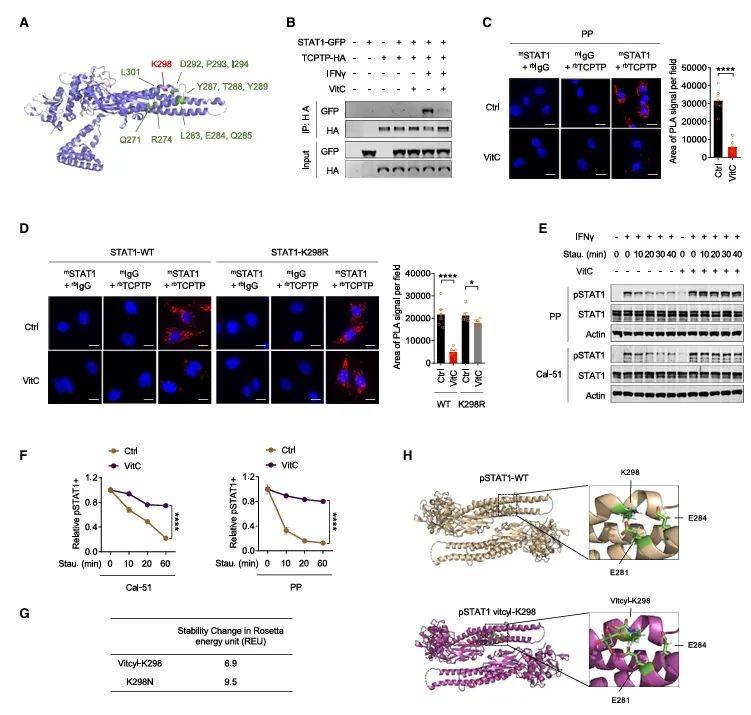 图4 STAT1 K298的vitcylation阻止了TCPTP对其的去磷酸化
图4 STAT1 K298的vitcylation阻止了TCPTP对其的去磷酸化
(图源:He, et al., Cell, 2025)
此外,研究团队还探讨了vitcylation对肿瘤抗原呈递的影响。通过实时定量PCR和流式细胞术,作者发现vitC处理显著上调了主要组织相容性复合体(MHC)/人类白细胞抗原(HLA)I类分子的表达(图5A, 5B)。这一效应在STAT1缺陷的细胞中消失,表明vitcylation通过STAT1信号通路调控了抗原呈递过程(图5E)。进一步的共培养实验表明,vitC处理的肿瘤细胞能够更有效地激活树突状细胞(DCs)和CD8+ T细胞,增强了抗肿瘤免疫反应(图5G, 5J)。更重要的是,TET2或HIF1α基因敲除并不影响这一过程,证明vitcylation是一条独立于经典通路的新机制。
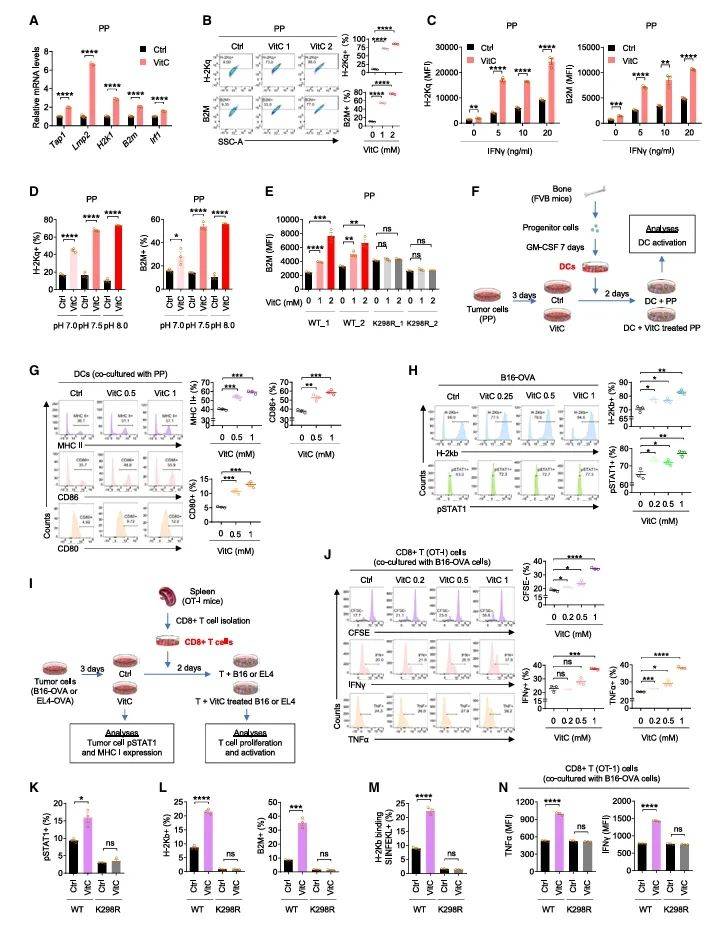 图5 STAT1 K298的vitcylation增强MHC/HLA I类的表达并促进肿瘤细胞的免疫原性
图5 STAT1 K298的vitcylation增强MHC/HLA I类的表达并促进肿瘤细胞的免疫原性
(图源:He, et al., Cell, 2025)
03、动物模型:从细胞到活体验证
在免疫健全小鼠中,究团队验证了vitC的抗肿瘤效果。高剂量vitC显著抑制肿瘤生长并延长生存期(图6B-C),而在免疫缺陷模型中完全无效(图6D-E),凸显其依赖适应性免疫。肿瘤微环境分析显示,vitC优先富集于瘤组织(图6O),驱动STAT1 vitcylation和MHC I上调(图6H),同时激活浸润T细胞产生IFN-γ和TNF-α(图6L-N)。这些结果共同表明,vitcylation通过增强STAT1信号通路,促进了肿瘤细胞的抗原呈递和免疫细胞的激活,从而增强了抗肿瘤免疫反应。当联合PD-1抗体时,抗肿瘤效应进一步协同增强(图7L),为临床转化提供了明确路径。
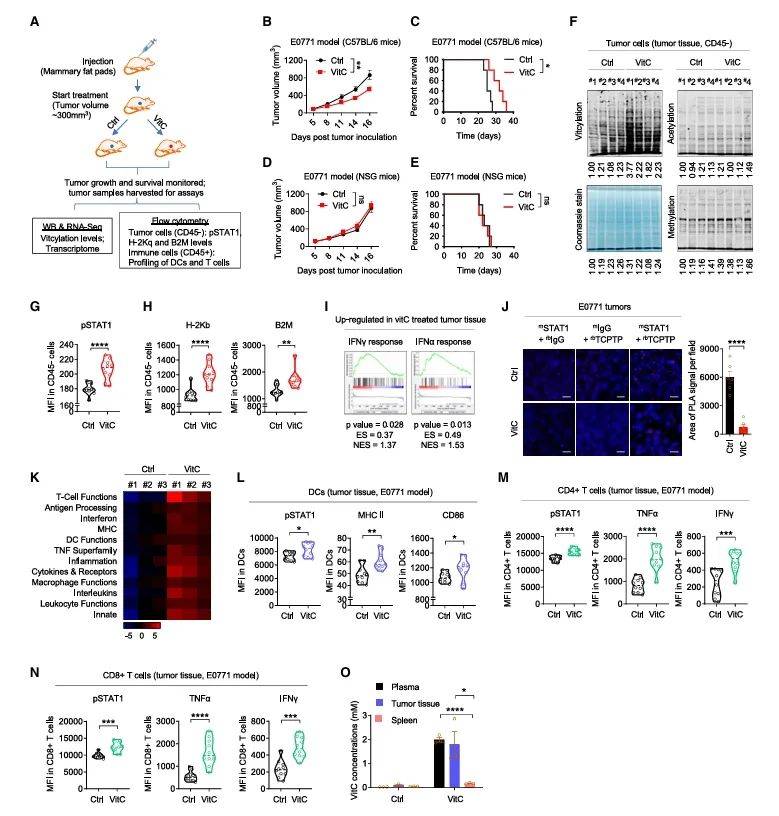 图6 维生素C在体内诱导肿瘤细胞vitcylation,增加STAT1介导的免疫反应
图6 维生素C在体内诱导肿瘤细胞vitcylation,增加STAT1介导的免疫反应
(图源:He, et al., Cell, 2025)
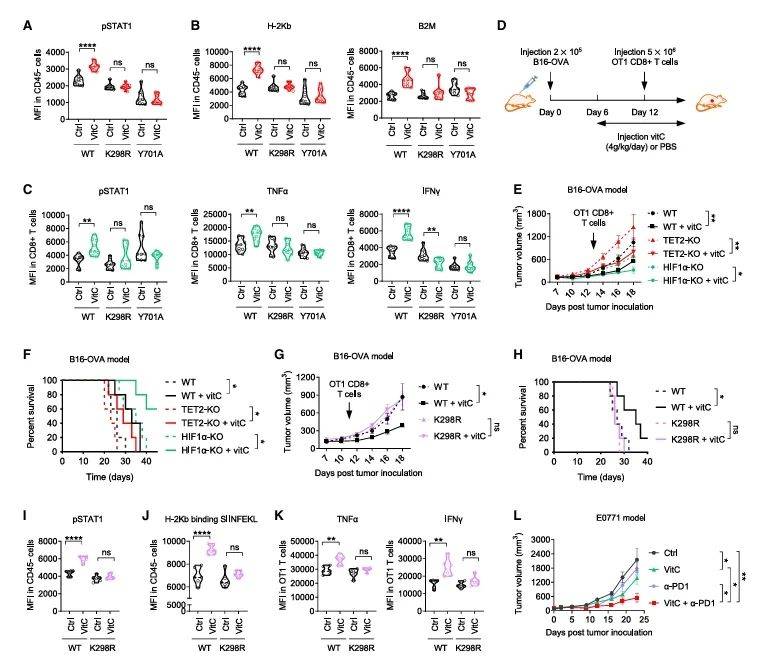 图7 维生素C通过STAT1体外循环调节免疫环境
图7 维生素C通过STAT1体外循环调节免疫环境
(图源:He, et al., Cell, 2025)
04、小结
这项研究如同一块拼图,填补了vitC机制与免疫调控之间的空白。vitcylation的发现不仅拓展了翻译后修饰的疆域,更揭示了代谢小分子直接调控信号蛋白的精确模式——这或许只是冰山一角。未来,探索vitcylation在自身免疫病、病毒感染等场景中的作用,开发位点特异性探针或抑制剂,以及优化vitC的时空递送策略,将成为领域的新焦点。当vitC从“抗氧化剂”升级为“免疫代谢调节剂”,癌症治疗的工具箱又添一把密钥。
05、拜谱小结
拜谱生物,作为国内领先的多组学公司,可提供完善成熟的蛋白组学、代谢组学、转录组学等多组学产品技术服务。在修饰组学方面,拜谱生物拥有完备且成熟的产品体系,涵盖多种热门修饰类型,针对复杂的科研需求,精心打造了修饰特色多组学解决方案。拜谱生物始终勇于探索前沿,凭借深厚的技术积累与持续创新,聚焦新型修饰检测技术开发,持续引领修饰组学发展,积极开展衣康酸化、血清素化修饰等新修饰组学产品服务,助力突破传统研究局限,探索更多修饰领域。期待您的咨询与合作,一同开启修饰组学研究的新篇章!
参考文献:
He X, Wang Q, Cheng X, Wang W, Li Y, Nan Y, Wu J, Xiu B, Jiang T, Bergholz JS, Gu H, Chen F, Fan G, Sun L, Xie S, Zou J, Lin S, Wei Y, Lee J, Asara JM, Zhang K, Cantley LC, Zhao JJ. Lysine vitcylation is a vitamin C-derived protein modification that enhances STAT1-mediated immune response. Cell. 2025 Feb 27:S0092-8674(25)00145-X. doi: 10.1016/j.cell.2025.01.043