

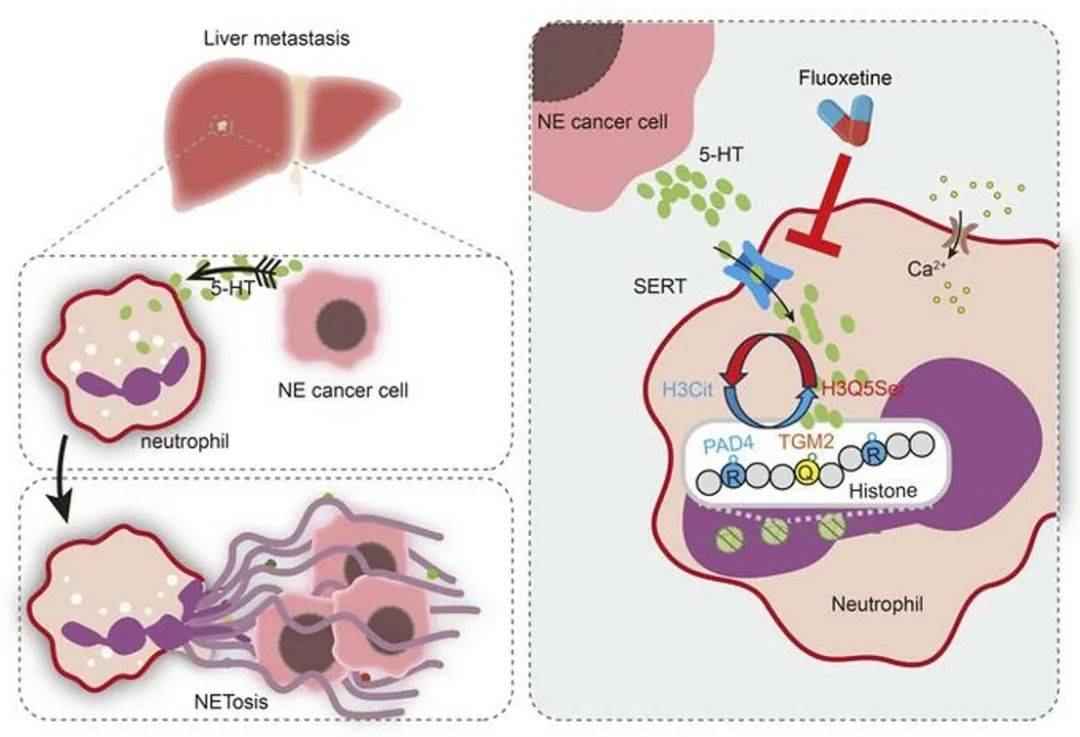
在肿瘤转移研究领域,神经内分泌肿瘤(如前列腺神经内分泌癌、小细胞肺癌等)的肝转移因其高发性(45%以上)和极低生存率,始终是临床治疗的棘手难题。传统疗法多聚焦于肿瘤细胞自身,却忽视了肿瘤微环境中免疫细胞的动态调控作用。尤其在中性粒细胞胞外陷阱(NETs)领域,其如何被肿瘤信号“劫持”以促进转移的机制仍不明晰,靶向干预策略更是空白。
2025年2月5日上海交通大学朱鹤研究员团队在J Clin Invest杂志(IF 13.3)上发表了题为“5-HT orchestrates Histone Serotonylation and Citrullination to Drive Neutrophil Extracellular Traps and Liver Metastasis”的研究文章,本研究通过免疫浸润分析(IOBR)、基因编辑模型与药理学干预,首次揭示了神经内分泌肿瘤分泌的5-羟色胺(5-HT)通过诱导组蛋白H3Q5位点血清素化(H3Q5ser)与H3瓜氨酸化(H3cit)的协同修饰,驱动NETs形成并促进肝转移的全新机制,不仅为理解肿瘤-免疫互作提供了新视角,更通过FDA批准的抗抑郁药氟西汀(SERT抑制剂)的疗效验证,提出了“老药新用”的临床转化策略。

01、机制图
02、临床数据揭示肝转移微环境的中性粒细胞特征
研究团队首先从癌症基因组数据库(SU2C)入手,通过免疫浸润分析发现,在神经内分泌前列腺癌(NEPC)患者的肝转移灶中,中性粒细胞是最富集的免疫细胞(图1A),且其浸润水平显著高于其他转移部位(图1B)。为进一步验证中性粒细胞的功能,作者构建了NEPC原位移植小鼠模型(PbCre+;Rb1Δ/Δ;Trp53Δ/Δ),发现肝脏微转移灶(<200 μm)中CD11b+Ly6G+中性粒细胞数量激增(图1C-D)。免疫荧光与组织染色显示,NETs标志物H3cit与中性粒细胞标记MPO共定位区域在转移灶显著增多(图1E-F),且DNase I降解NETs可显著抑制肝转移并延长小鼠生存期(图1G-K)。体外实验进一步证实,NETs通过增强肿瘤细胞迁移与黏附能力驱动转移(图1L-M)。这些数据首次将中性粒细胞与NETs定位为神经内分泌肿瘤肝转移的关键推手。
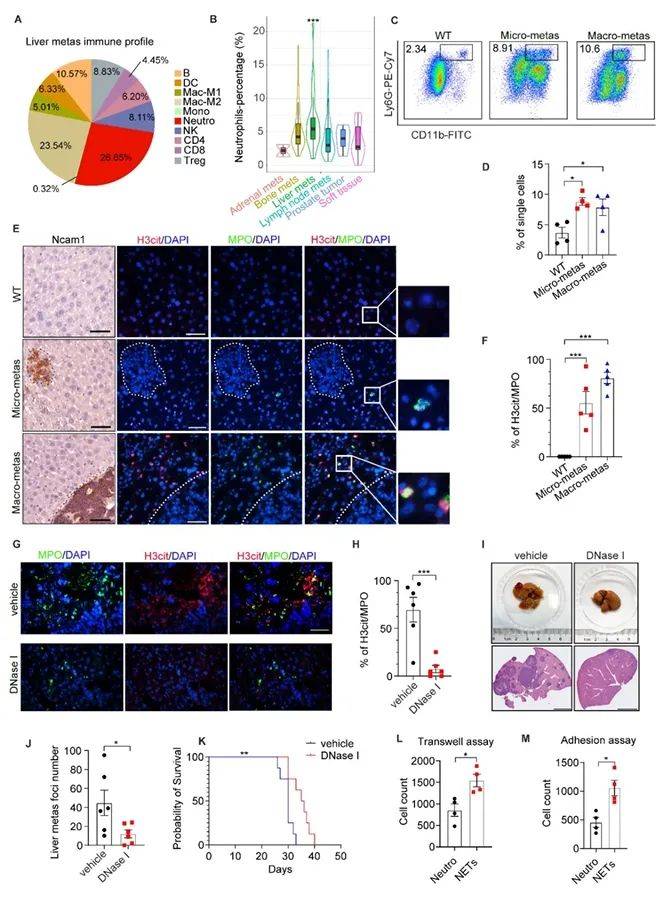 图1 在NEPC肝转移中检测到中性粒细胞浸润和NETs
图1 在NEPC肝转移中检测到中性粒细胞浸润和NETs
(图源:Liu, et al., J Clin Invest, 2025)
03、神经内分泌肿瘤分泌5-HT激活NETs形成
基于神经内分泌肿瘤高表达5-HT合成酶TPH1的临床特征,作者提出假说:肿瘤来源的5-HT可能通过调控中性粒细胞表型影响转移。体外实验中,5-HT处理可显著诱导小鼠骨髓源性中性粒细胞(BMDNs)和人外周血中性粒细胞(PBDNs)释放NETs(图2A-F),且MNase消化实验证实5-HT加速染色质解聚(图2G)。敲低NEPC类器官的TPH1基因(shTph1)后,其条件培养基诱导NETs的能力显著下降,而外源补充5-HT可恢复NETs形成与肝转移(图2C-J)。这一现象在多种神经内分泌肿瘤模型(小细胞肺癌NCI-H82、甲状腺髓样癌TT)中均得到验证,提示5-HT驱动的NETs形成是神经内分泌肿瘤肝转移的普适性机制。
 图2 NEPC衍生的5-HT可促进NETs的形成和肝转移
图2 NEPC衍生的5-HT可促进NETs的形成和肝转移
(图源:Liu, et al., J Clin Invest, 2025)
04、组蛋白修饰协同调控染色质解聚:H3Q5ser与H3cit的“双向赋能”
为深入解析5-HT如何通过表观遗传机制驱动NETs形成,研究团队聚焦于组蛋白H3的两种关键修饰——H3Q5位点血清素化(H3Q5ser)与H3瓜氨酸化(H3cit)。H3Q5ser由转谷氨酰胺酶TGM2催化,将5-HT共价连接到组蛋白H3第5位谷氨酰胺;H3cit则由肽酰精氨酸脱亚胺酶PAD4介导,精氨酸残基脱氨基生成瓜氨酸(图3A)。这两种修饰的协同作用如何调控染色质解聚?
1、5-HT触发组蛋白修饰的动态变化
通过免疫荧光与免疫印迹分析,作者发现5-HT刺激显著提升了中性粒细胞中H3Q5ser与H3cit的水平(图3B-F)。值得注意的是,抑制SERT(氟西汀)或TGM2(LDN-27219)不仅阻断了H3Q5ser,还导致H3cit的同步下降(图3B-G)。这一现象提示两种修饰可能存在相互依赖的调控关系。
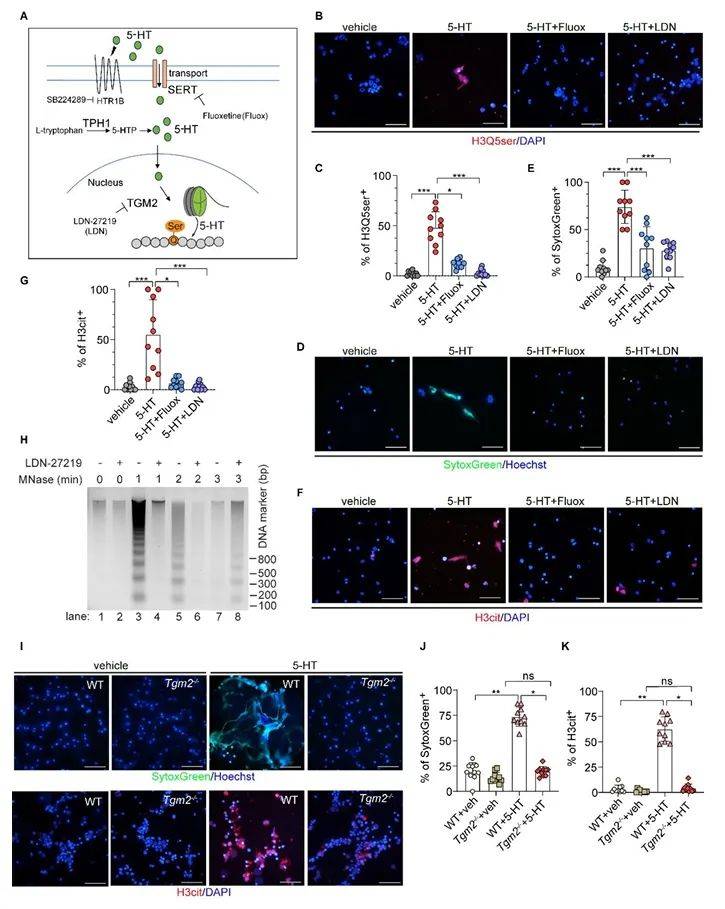 图3 5-HT 在NETs形成过程中诱导中性粒细胞中的组蛋白血清素化
图3 5-HT 在NETs形成过程中诱导中性粒细胞中的组蛋白血清素化
(图源:Liu, et al., J Clin Invest, 2025)
2、基因编辑与突变体揭示修饰协同性
在HL-60细胞中过表达H3.3(Q5A)突变体(无法发生血清素化)后,H3cit水平显著降低(图4B),且染色质对MNase的敏感性减弱(图4G),表明H3Q5ser缺失直接抑制了染色质解聚。反之,当H3瓜氨酸化位点突变(H3.3-R2/8/17A)时,H3Q5ser修饰也显著减少(图7B)。这些数据首次证明两种修饰在功能上互为前提,形成正反馈循环。
 图4 H3Q5Ser修饰促进NETs的形成
图4 H3Q5Ser修饰促进NETs的形成
(图源:Liu, et al., J Clin Invest, 2025)
3、酶活性与蛋白互作的分子机制
通过免疫共沉淀(Co-IP)与体外Pull-down实验,作者发现TGM2与PAD4直接结合(图5H-K),且5-HT处理可增强两者的相互作用。进一步结构域分析显示,PAD4的免疫球蛋白样结构域(D1)与TGM2的C端桶状结构域(D3)是结合的关键区域。这种酶-酶复合体的形成,为H3Q5ser与H3cit的协同催化提供了结构基础。
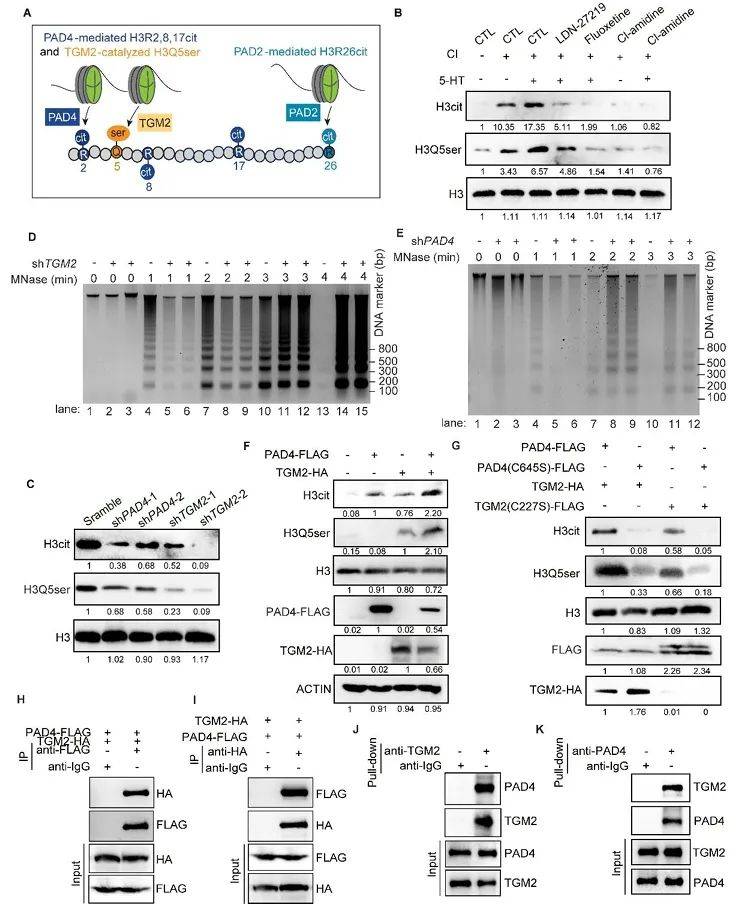 图5 TGM2与PAD4合作协调组蛋白血清素化和瓜氨酸化。
图5 TGM2与PAD4合作协调组蛋白血清素化和瓜氨酸化。
(图源:Liu, et al., J Clin Invest, 2025)
4、基因组共定位与功能关联
CUT&Tag测序显示,H3Q5ser与H3cit在基因组上高度重叠(图6I-L),共同占据NETs相关基因(如MPO、DNASE1、ITGAM)的启动子与增强子区域(图6M)。体外催化实验进一步证实:H3Q5ser修饰的肽段可显著增强PAD4的瓜氨酸化活性(图6E-F),而H3cit修饰的肽段同样促进TGM2的血清素化效率(图6G-H)。这一双向赋能机制,最终通过染色质解聚“锁死”中性粒细胞的NETs释放程序。
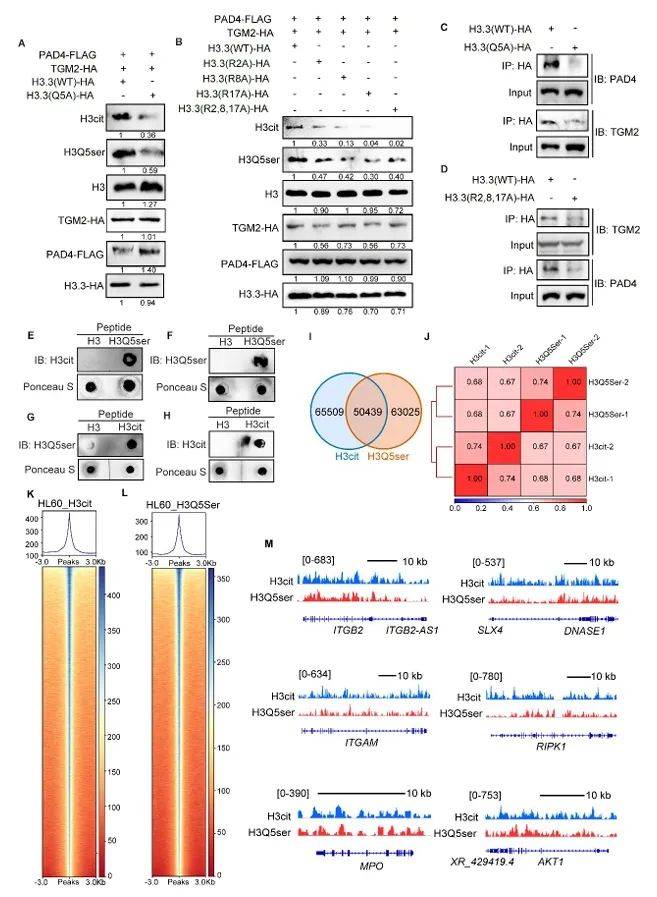 图6 H3Q5ser和H3cit相互增强,并在全基因组范围内共享染色质占有率
图6 H3Q5ser和H3cit相互增强,并在全基因组范围内共享染色质占有率
(图源:Liu, et al., J Clin Invest, 2025)
05、靶向干预:从机制到转化的闭环验证
基于上述机制,作者在多种小鼠模型中验证了TGM2抑制剂LDN-27219和SERT抑制剂氟西汀的疗效。LDN-27219处理可显著抑制NEPC肝转移,并降低肝脏中性粒细胞的H3Q5ser与H3cit水平(图7A-H)。氟西汀作为FDA已批准的抗抑郁药,通过阻断5-HT摄入,同样有效减少NETs形成和转移灶数量(图8A-N)。值得注意的是,氟西汀在抑制肿瘤细胞自身增殖(既往研究)与微环境重塑(本研究)中具有“双刃剑”效应,为神经内分泌肿瘤的联合治疗提供了新思路。
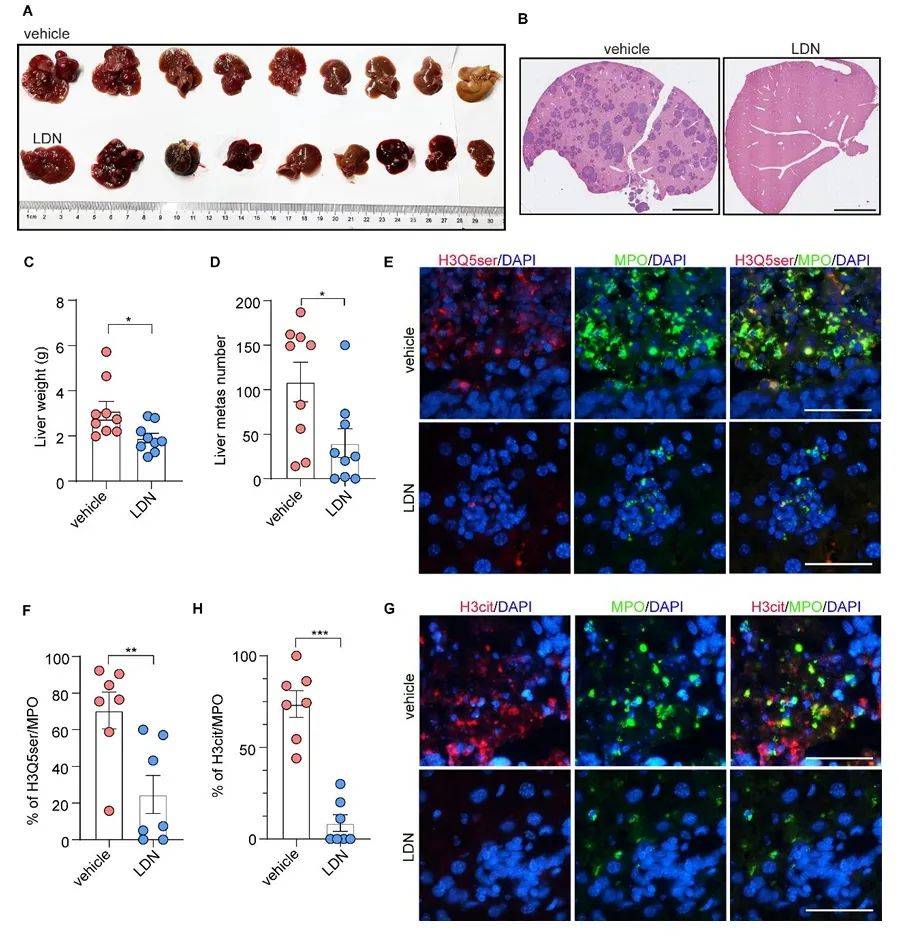 图7 TGM2抑制消除了NEPC小鼠模型中NETs的形成和肝转移
图7 TGM2抑制消除了NEPC小鼠模型中NETs的形成和肝转移
(图源:Liu, et al., J Clin Invest, 2025)
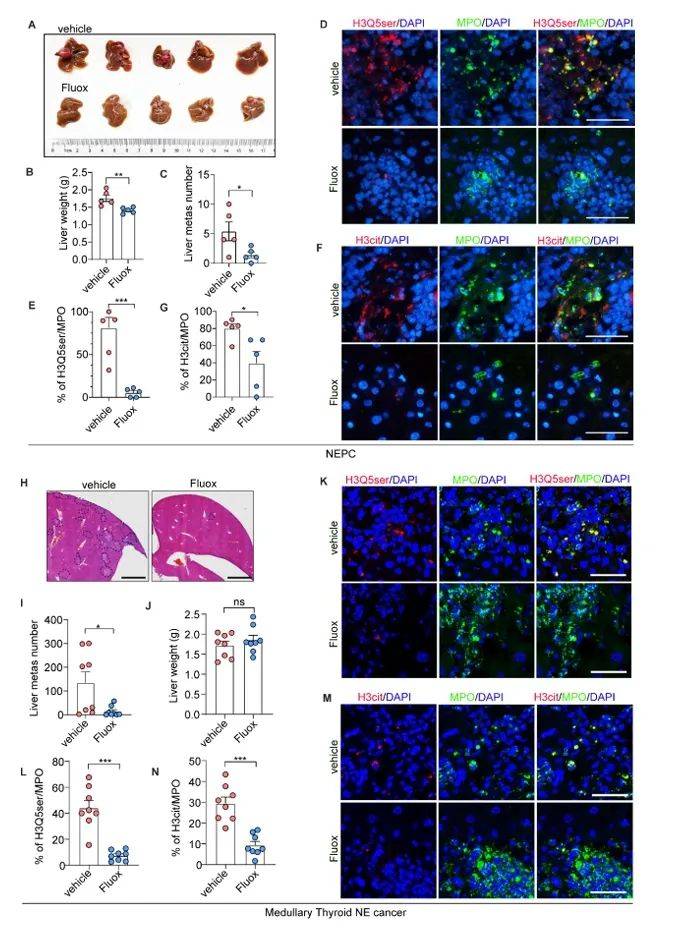 图8 SERT抑制剂氟西汀抑制NE癌症中的NETs形成和肝转移。
图8 SERT抑制剂氟西汀抑制NE癌症中的NETs形成和肝转移。
(图源:Liu, et al., J Clin Invest, 2025)
06、小结
技术创新:本研究整合IOBR分析、CUT&Tag表观基因组学与活体成像技术,建立了从临床数据到分子机制的全链条研究框架。
理论突破:首次揭示5-HT通过TGM2-PAD4轴驱动组蛋白修饰协同作用,提出“神经递质-表观遗传-免疫微环境”三方互作的新范式。
应用潜力:氟西汀的疗效验证为神经内分泌肿瘤肝转移提供了即时可用的干预策略,且其安全性已通过临床验证,极大缩短了转化周期。
07、拜谱小结
血清素化修饰作为一种新型蛋白翻译后修饰,是血清素发挥生物学功能的主要机制之一,已发现广泛参与癌症、神经性疾病、代谢性疾病的病理机制。血清素化修饰的靶蛋白包括组蛋白和非组蛋白,目前组蛋白主要集中H3Q5位点,该位点的血清素化修饰可触发下游一系列基因的转录;非组蛋白的血清素化修饰改变了底物的酶活性、细胞定位、蛋白互作、蛋白构象等,进而影响其参与的下游表型。当前血清素化修饰研究主要集中于发现更多的修饰底物并揭示其调控机制,另一方面基于血清素化修饰系统开发特异性的药物。
拜谱生物拜作为国内领先的多组学公司,可提供完善成熟的蛋白组学、代谢组学、转录组学等多组学产品技术服务体系。近期,拜谱生物推出了基于化学蛋白质组学的血清素化修饰组学产品,一方面可以从蛋白层面上筛选可能发生修饰的靶点并结合生物信息学分析获得靶点蛋白的功能信息,另一方面可以利用体外酶催化反应结合LCMS/MS方法对目标蛋白的修饰位点进行精准定位;同时,拜谱生物具有血清素的靶向代谢组学产品,结合标准品可实现样本中代谢物的绝对定量,为血清素作用机制研究提供帮助。欢迎感兴趣的老师致电咨询。
参考文献:
Liu K, Zhang Y, Du G, Chen X, Xiao L, Jiang L, Jing N, Xu P, Zhao C, Liu Y, Zhao H, Sun Y, Wang J, Cheng C, Wang D, Pan J, Xue W, Zhang P, Zhang ZG, Gao WQ, Jiang SH, Zhang K, Zhu HH. 5-HT orchestrates Histone Serotonylation and Citrullination to Drive Neutrophil Extracellular Traps and Liver Metastasis. J Clin Invest. 2025 Feb 4:e183544. doi: 10.1172/JCI183544