

尽管有许多研究探讨了多能干细胞(PSC)在正常培养条件下保持自我更新和多能性的分子机制,但PSC如何在应激条件下生存的机制在很大程度上仍未得到解决。转录后/翻译调控对PSC至关重要,但在外源性和内在应激条件下,PSC如何在翻译水平上协调和平衡其生存和分化尚不清楚。
2025年2月23日浙江大学王英杰老师团队等在Stem Cell Research & Therapy杂志(7.1)上发表“OCT4 translationally promotes AKT signaling as an RNA-binding protein in stressed pluripotent stem cells”的文章,文章发现在低氧应激条件下,转录因子OCT4可以作为RNA结合蛋白在转录后水平激活AKT信号通路,维持多能干细胞的存活和多能性。研究团队通过HITS-CLIP等组学分析技术,发现OCT4蛋白能与一系列靶mRNA结合。在应激条件下,OCT4蛋白可脱离DNA结合模式,转而结合到AKT通路相关基因(如AKT1)mRNA的5'UTR区域,发挥RBP和ITAF的功能。进一步利用翻译组测序(RNC-seq)和蛋白质组学分析证实,这种结合显著提升了靶mRNA的翻译效率,导致AKT通路蛋白的快速翻译,促进细胞存活。拜谱生物为该研究提供了蛋白互作组检测服务,助力揭示OCT4的互作蛋白。该文章通讯作者王英杰老师为拜谱生物首席科学顾问,拜谱生物总经理呼建文联合署名发表。

英文标题:OCT4 translationally promotes AKT signaling as an RNA-binding protein in stressed pluripotent stem cells, Stem Cell Research & Therapy, IF 7.1, 2025
作者单位:浙江大学
研究材料:人类胚胎干细胞系H1和H9、NCCIT细胞
组学技术:转录组、蛋白互作组
PART.1
研究结果
OCT在转录后水平激活AKT1蛋白表达
通过RNA干扰敲低OCT4,发现AKT1 mRNA水平显著升高,而蛋白质水平变化不大。这表明OCT4在AKT1表达调控中存在转录后/翻译水平的差异。OCT4作为一种主要位于细胞核并发挥功能的转录因子,而大部分转录后/翻译过程发生在细胞质中,作者通过亚细胞分离获得胞质、细胞核组分,发现细胞质中的OCT约占总蛋白的10%。
通过交联免疫沉淀测序技术(HITS-CLIP)描绘OCT4-RNA互作组
由于之前的研究表明OCT4可能是RBP,因此研究人员决定使用HITS-CLIP技术系统地解析OCT4-RNA相互作用组。研究人员使用CRISPR/Cas9系统构建了TAP-OCT4 H1细胞系,该细胞系在OCT4的5’UTR后方敲入了一个TAP标签,以便更容易地分离和富集OCT4-RNA复合物。通过这种方法,研究人员识别了大量OCT4结合位点,这些位点分布在5’UTR、CDS、3’UTR、内含子、非编码基因外显子、基因间区域和反义CLIP-seq标签中(图1)。使用MEME软件对OCT4结合位点进行motif分析,发现GC-rich的(5′-GCCG-3′)序列在OCT4结合位点中显著富集,尤其是位于翻译起始位点的GC-rich六聚体(图1)。
 图1 OTC4结合靶基因mRNA的5’-UTR区域
图1 OTC4结合靶基因mRNA的5’-UTR区域
(源自:Chen, et al., Stem Cell Research & Therapy, 2025)
通过OCT4结合PI3K/AKT通路基因的mRNA
生物信息学分析显示OCT4结合的基因主要参与RNA代谢、翻译、各种刺激和压力反应等生物学过程,这表明OCT4在这些过程中可能发挥重要的调控作用。这些基因的功能包括蛋白质磷酸化、内源性凋亡信号通路和干细胞维持等。GO分析表明,OCT4结合的基因分布在细胞的大部分区域,包括细胞核、细胞质和细胞膜。GO分子功能分析表明,OCT4结合的基因具有DNA结合、RNA结合和激酶结合等功能。KEGG通路分析将OCT4结合的基因聚类到几个通路中,其中包括细胞粘附、PI3K/Akt信号通路和PPAR信号通路。与AKT调控作用一致,OCT4结合到多个PI3K/AKT信号通路基因的mRNA,包括PIK3CD、PIK3R2、PDPK1、AKT1、KRAS、BAD和EIF4E。这表明OCT4可能通过直接结合其5’UTR来调节这些基因的翻译。
OCT4与互作蛋白作用于翻译起始的调控
为了更准确地鉴定细胞质中的OCT4互作蛋白,研究人员对细胞质蛋白进行了温和的裂解,并省略了裂解缓冲液中添加核酸酶。这种条件不仅保留了蛋白/核酸相互作用,还使核质TFs与基因组DNA共沉淀,从而相对富集了细胞质蛋白和其他可溶性核质蛋白(如剪接因子)。通过这种方法,研究人员可以最大程度地减少核质中OCT4转录因子作用的干扰,并更专注于其作为RBP的新功能。研究人员使用质谱技术鉴定了27个OCT4互作蛋白,并分析了它们的亚细胞定位、分子功能和生物学过程(图2)。这些蛋白主要位于细胞核、细胞质和细胞膜,并具有翻译因子结合、RNA结合和蛋白结合等功能。STRING蛋白组学网络分析进一步揭示了多个OCT4互作蛋白与翻译、转录、压力反应和转运等4个组相关(图3)。这些结果表明,OCT4可能参与mRNA翻译的调控。在27个OCT4互作蛋白中,有经典的HNRNPA1和EIF3的组成部分EIF3G,这表明OCT4可能参与帽依赖性和/或帽非依赖性但EIF4F非依赖性翻译起始过程。作者进一步证实OCT4、HNRNPA1和EIF3G可能共同参与PI3K/AKT信号通路基因的帽非依赖性和/或帽依赖性但EIF4F非依赖性翻译起始过程。
 图2 OTC4蛋白互作组分析
图2 OTC4蛋白互作组分析
(源自:Chen, et al., Stem Cell Research & Therapy, 2025)
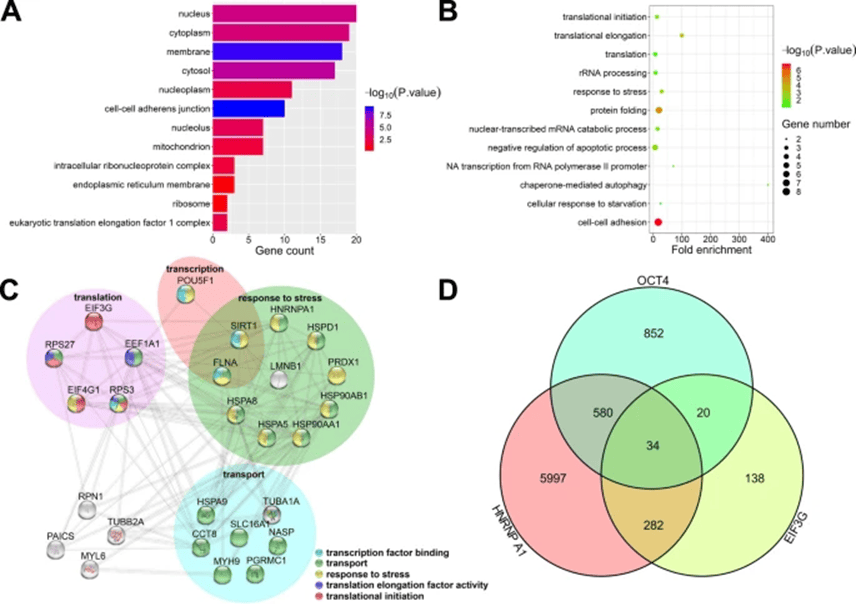 图3 OTC4蛋白互作组功能分析
图3 OTC4蛋白互作组功能分析
(源自:Chen, et al., Stem Cell Research & Therapy, 2025)
OCT4调控低氧条件下PI3K/AKT通路基因的翻译比率
作者通过翻译组测序和转录组测序研究了低氧条件下OCT4在调节PI3K/AKT信号通路基因mRNA翻译以及全局基因中的作用。作者整合了翻译组和转录组的RPKM数据获得了RNA的翻译比率,即总mRNA中发生翻译的mRNA比例。KEGG功能富集显示下调翻译比率的基因主要参与PI3K/AKT信号通路、mTOR信号通路、胰岛素信号通路、凋亡和吞噬体通路等,而上调翻译比率的基因主要参与基本转录因子、泛素介导的蛋白质降解、细胞周期和PI3K/AKT信号通路等(图4)。结果显示OCT4在缺氧条件下对PI3K/AKT信号通路基因的翻译至关重要。OCT4可能通过IRES介导的帽非依赖性翻译途径促进PI3K/AKT信号通路基因的翻译。
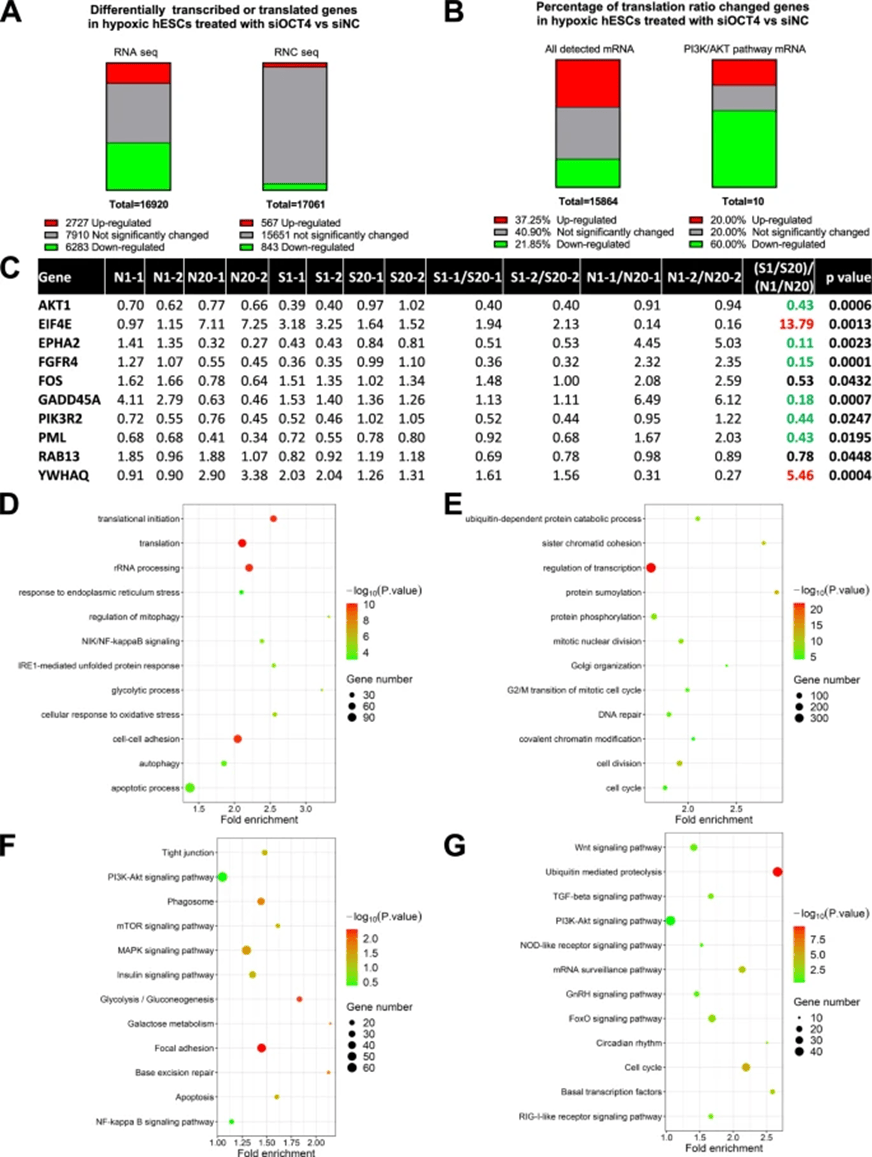 图4 低氧条件下的OTC4对蛋白翻译的全局性调控
图4 低氧条件下的OTC4对蛋白翻译的全局性调控
(源自:Chen, et al., Stem Cell Research & Therapy, 2025)
OCT4激活的AKT1翻译来应对缺氧和氧化应激
为了进一步研究OCT4与AKT1mRNA结合的机制,研究人员使用HKINT技术(杂合子敲入N端标签)敲除了AKT1基因5’UTR的一部分,以破坏OCT4与AKT1 mRNA的相互作用。结果表明,TAP-AKT1蛋白水平显著低于野生型AKT1蛋白水平,而TAP-AKT1 mRNA水平则显著高于野生型AKT1 mRNA水平,这表明破坏OCT4与AKT1 mRNA的相互作用会抑制TAP-AKT1的翻译。在缺氧条件下,野生型AKT1蛋白水平在缺氧处理后8小时显著升高,然后在24小时后恢复到原水平。而TAP-AKT1蛋白水平则在整个缺氧期间持续下降。TAP-AKT1细胞比野生型细胞更容易分化为外胚层和内胚层,但不容易分化为间充质。综上,OCT4通过IRES介导的途径激活AKT1的翻译,从而在缺氧条件下维持PSCs的存活和自我更新能力。
PART.2
文章小结
综上所述,本研究发现OCT4是人类多能干细胞中的一种RNA结合蛋白,它结合到mRNAs的5’-UTR、3’-UTR和CDS区域。在OCT4蛋白质相互作用组中检测到多个已知参与IRES介导翻译起始的蛋白质,结合RNC-seq/RNA-seq分析进一步确认了OCT4在PSCs响应缺氧压力的翻译调控中的关键作用。值得注意的是,OCT4在缺氧条件下通过IRES介导途径结合到AKT1和多个PI3K/AKT信号通路基因mRNAs的GC-rich元件上,并促进它们的翻译起始。通过HKINT方法特异性破坏AKT1 mRNA的5’-UTR结构和OCT4-5’-UTR相互作用显著降低了AKT1的翻译水平,导致PSCs对氧化应激诱导的凋亡死亡更为敏感,并优先向外胚层和内胚层分化。
PART.3
拜谱小结
本研究通过多组学技术揭示了OCT4作为一种新型的抗应激RNA结合蛋白,在应激条件下通过翻译调控促进多能干细胞的存活和自我更新。OCT4通过结合到AKT1等PI3K/AKT通路基因mRNA的5'-UTR区域,促进其在应激条件下的翻译起始,从而在PSCs的存活和分化中发挥关键作用。拜谱生物为该研究提供了蛋白互作组质谱分析技术,拜谱生物可提供成熟完善的转录组学、蛋白组学、代谢组学以及多组学联合产品技术服务体系,助力发表高分文献,欢迎致电咨询!
参考文献:
Chen W, Chen X, Chen C, et al. OCT4 translationally promotes AKT signaling as an RNA-binding protein in stressed pluripotent stem cells. Stem Cell Res Ther. 2025;16(1):84. Published 2025 Feb 23. doi:10.1186/s13287-025-04229-1