

近年来,全球儿童肥胖率显著上升,随之而来的代谢综合征、脂肪肝等健康问题日益严峻。然而,儿童发育过程中血浆蛋白质组的动态变化及其调控机制仍不明确。血浆蛋白不仅是疾病诊断的关键生物标志物,也是理解遗传与环境互作的重要窗口。传统研究多聚焦于成人群体,而儿童和青少年阶段的蛋白质组特征受青春期激素波动、免疫系统成熟等多因素影响,亟需系统性探索。
2025年2月19日哥本哈根大学Matthias Mann教授团队在Nature Genetics杂志(IF 31.7)上发表了题为“Plasma proteome variation and its genetic determinants in children and adolescents”的研究文章,通过大规模质谱蛋白质组学分析,揭示了遗传变异、年龄、性别和体重指数(BMI)对血浆蛋白质组的调控规律,并鉴定出与心血管代谢疾病相关的因果基因。本文将从研究设计、方法创新到生物学发现,深度解析这一突破性成果。

构建高质量儿童血浆蛋白质组图谱
为了构建覆盖儿童至青少年阶段的队列,并建立高效、可重复的质谱工作流程,研究团队精心设计了实验方案。他们纳入了来自丹麦HOLBAEK研究的2,147名5-20岁儿童和青少年作为发现队列,其中55%为肥胖儿童,45%来自普通人群(图1A)。这一设计巧妙地平衡了研究群体的多样性与代表性,为后续分析奠定了坚实基础。通过优化数据非依赖性采集(DIA)质谱技术,结合新型Orbitrap Astral质谱仪,研究团队在单次运行中定量了1,216种血浆蛋白,数据完整性达91%,技术重复性中位变异系数为33%(图1C)。这一技术突破显著提升了大规模临床样本的蛋白质组分析效率,为后续深入研究提供了高质量的数据支持。
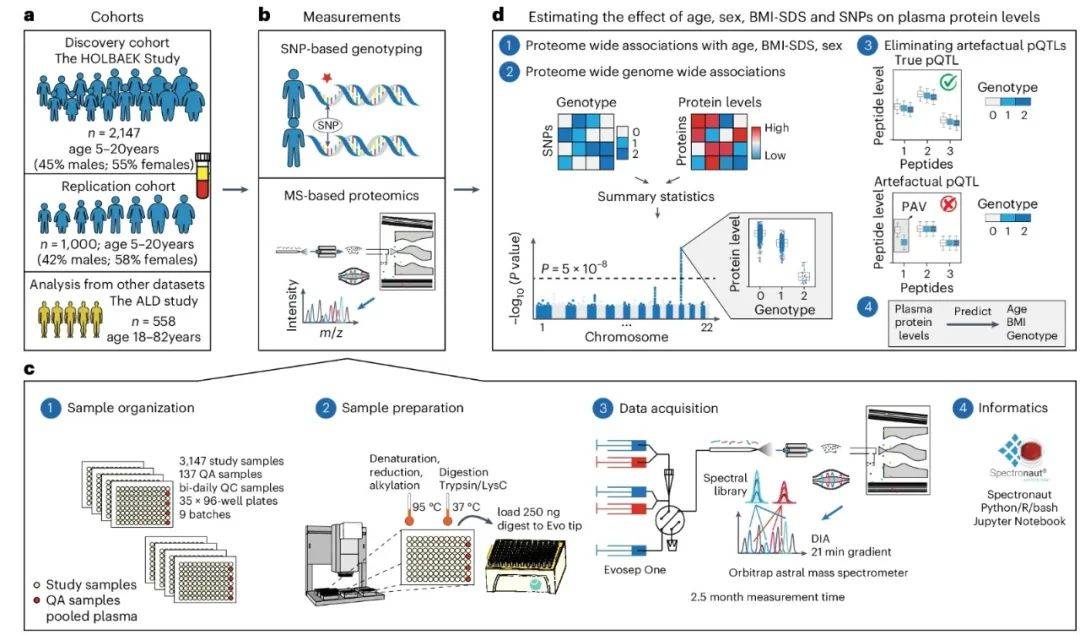 图1 研究概述和蛋白质组学工作流程
图1 研究概述和蛋白质组学工作流程
(图源:Niu, et al., Nat Genet, 2025)
人口统计学因素对血浆蛋白质组的影响
在明确了高质量蛋白质组图谱的构建后,研究团队进一步探索了年龄、性别和BMI对血浆蛋白质组的独立及交互影响。通过多元线性回归模型分析,他们发现58%的蛋白质水平与年龄、性别或BMI显著相关(图2B)。例如,胰岛素样生长因子1(IGF1)在青春期达到峰值后下降,而骨发育相关蛋白(如ACAN、COL1A1)在青春期后显著降低,这一现象如同骨骼生长的“时间钟”,精准地反映了骨骼生长板的闭合过程。此外,肥胖儿童中脂联素和炎症标志物(如CRP)水平异常,提示代谢紊乱的早期信号。这些发现不仅揭示了儿童发育过程中蛋白质组的动态变化,也为理解儿童肥胖的潜在机制提供了重要线索。
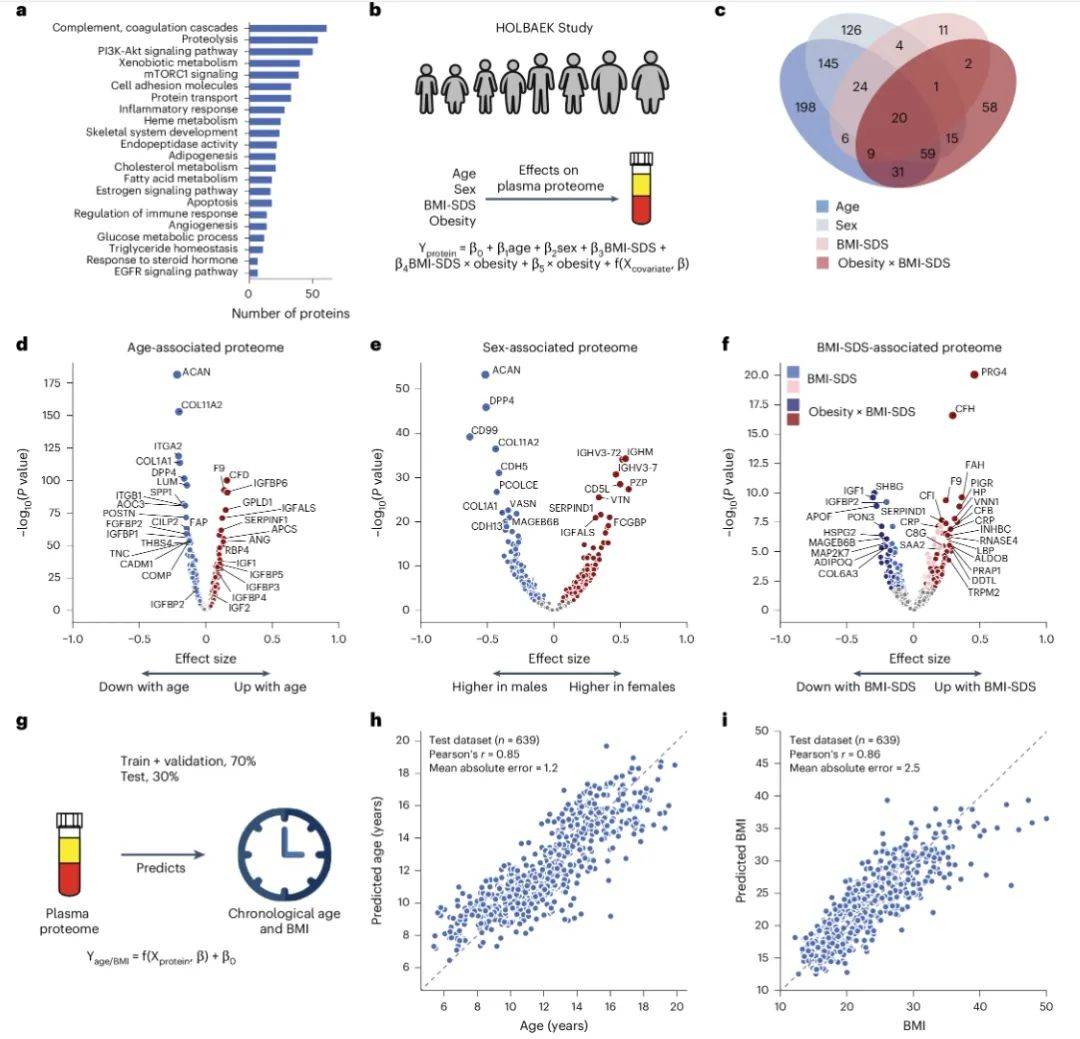 图2 年龄相关、性别相关和BMI-SDS相关血浆蛋白
图2 年龄相关、性别相关和BMI-SDS相关血浆蛋白
(图源:Niu, et al., Nat Genet, 2025)
遗传变异对蛋白质组的调控
在解析了人口统计学因素的影响后,研究团队将目光转向了遗传变异对蛋白质组的调控。全基因组关联分析(GWAS)揭示了1,947个显著的蛋白质数量性状位点(pQTL),其中62%为顺式调控(cis-pQTL),25%的位点可调控多种蛋白质(图3A, E)。例如,rs2232613-T突变使脂多糖结合蛋白(LBP)水平降低四倍,可能影响先天免疫功能。这一发现如同在基因组中找到了蛋白质表达的“开关”,揭示了遗传变异对蛋白质组的精细调控。通过肽段水平验证,研究排除了技术假象(如氨基酸变异导致的检测偏倚),确认了77%的pQTL具有多肽一致性支持(图3D)。这一结果不仅验证了研究方法的可靠性,也为后续的生物学解释提供了坚实基础。
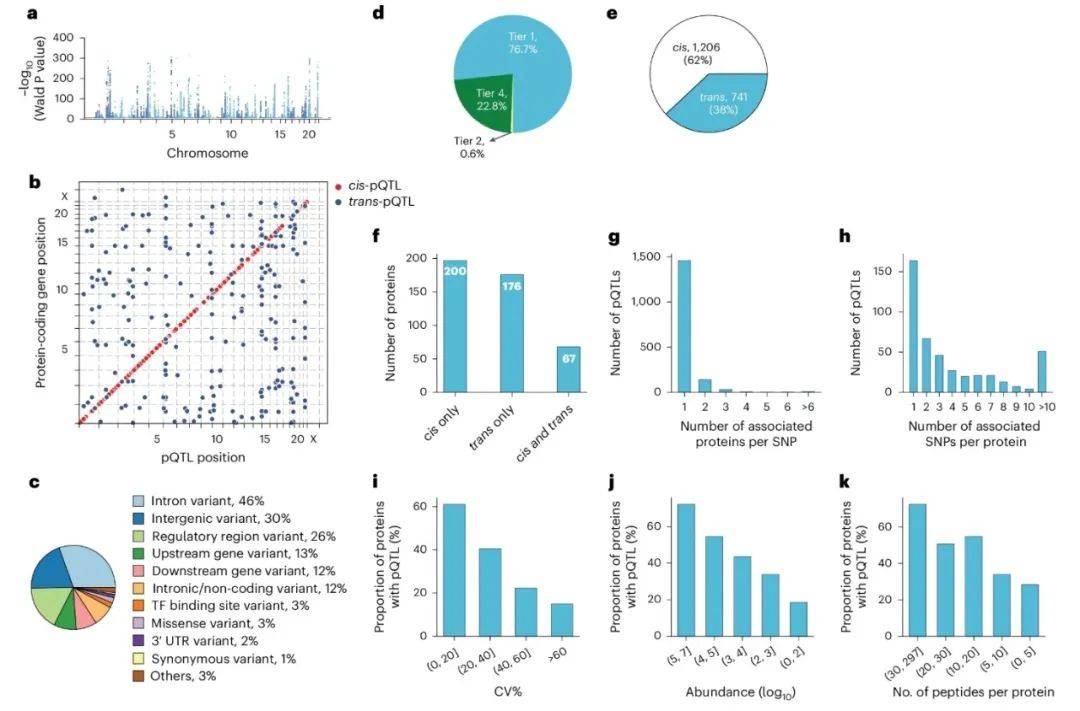 图3 pQTL的特性分析
图3 pQTL的特性分析
(图源:Niu, et al., Nat Genet, 2025)
遗传与环境的交互作用
值得注意的是,尽管遗传变异对蛋白质组的调控作用显著,但遗传与环境的交互作用同样不容忽视。为了量化遗传和非遗传因素对蛋白质水平变异的贡献,并评估pQTL的发育阶段稳定性,研究团队进行了方差分解分析。结果显示,pQTL平均解释11%的蛋白质水平变异,部分蛋白(如SHBG)主要受年龄和肥胖调控(图4A)。尽管遗传效应在5-20岁年龄段高度稳定(Pearson相关性0.95-0.98),但成年队列验证表明,部分pQTL效应随年龄增长减弱,提示环境因素的累积影响(图4B-D)。这一发现如同在遗传与环境的“拔河比赛”中,揭示了两者在不同发育阶段的动态平衡,为理解儿童发育过程中的健康与疾病提供了新的视角。
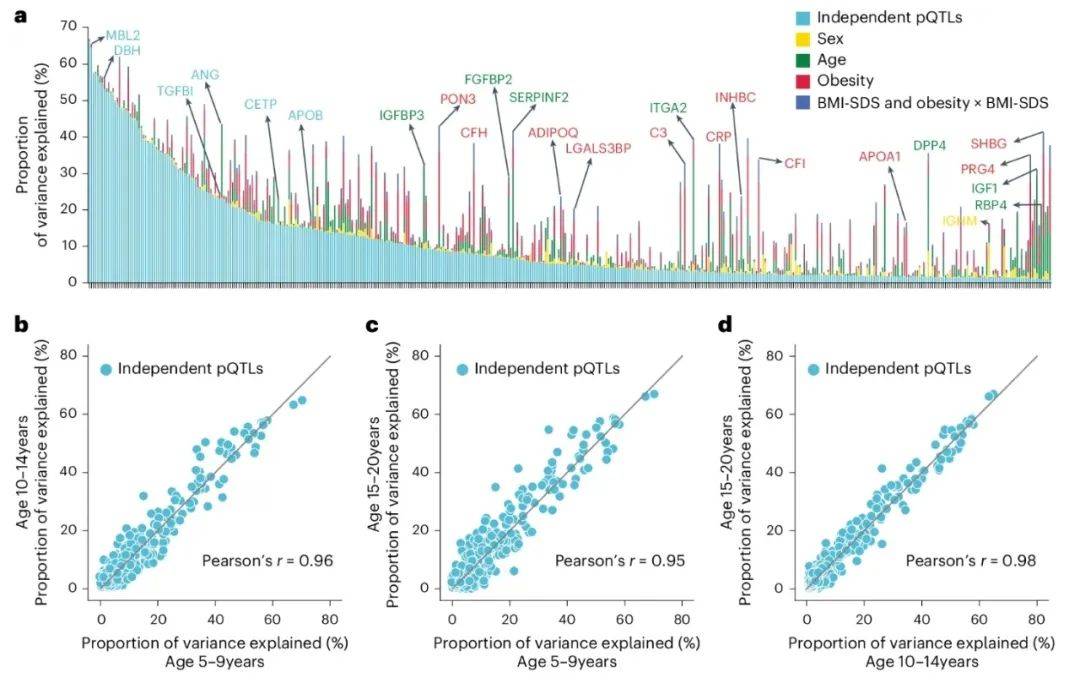 图4 由各种因素引起的血浆蛋白水平差异
图4 由各种因素引起的血浆蛋白水平差异
(图源:Niu, et al., Nat Genet, 2025)
pQTL与疾病性状的因果关联
在明确了遗传与环境的交互作用后,研究团队进一步探索了pQTL与心血管代谢疾病的因果关系。通过孟德尔随机化和共定位分析,他们鉴定了41个基因对33种疾病性状的因果关联(图5G)。例如,ABO基因座不仅调控血管性血友病因子(VWF),还通过MASP1影响2型糖尿病风险;APOE基因的ε4等位基因与阿尔茨海默病风险相关,同时下调神经发育蛋白SPTBN4(图5H)。这些发现如同在疾病机制的“拼图”中找到了关键的拼块,为精准医学提供了新的假说和潜在治疗靶点。
 图5 具有已知变异-性状关联的pQTL的效应大小和整合
图5 具有已知变异-性状关联的pQTL的效应大小和整合
(图源:Niu, et al., Nat Genet, 2025)
生物标志物的遗传优化策略
为了将研究成果转化为临床应用,研究团队评估了pQTL信息对生物标志物性能的提升作用。以肝纤维化标志物TGFBI为例,结合其pQTL基因型信息后,分类准确性显著提高(AUC从0.72提升至0.81)(图6F)。类似地,LBP基因型分层可优化脂肪肝诊断效能(图6G)。这一策略如同为生物标志物安装了“导航系统”,使其在疾病诊断中更加精准。这一成果不仅为个性化医疗提供了重要工具,也为未来儿童肥胖和代谢综合征的早期干预开辟了新的路径。
 图6 儿童和成人pQTL的复制
图6 儿童和成人pQTL的复制
(图源:Niu, et al., Nat Genet, 2025)
小结
本研究通过创新质谱技术与大规模队列设计,首次系统揭示了儿童至青少年阶段血浆蛋白质组的遗传与环境调控网络。70%的蛋白受年龄、性别或BMI调控,超三分之一由遗传变异主导,且这些pQTL从儿童期延续至成年。通过整合孟德尔随机化,研究锁定了41个心血管代谢疾病的潜在因果基因,为精准医学提供了分子基础。这一成果不仅推进了发育生物学认知,更为儿童肥胖、代谢综合征的早期干预开辟了新路径。
拜谱小结
拜谱生物作为一家国内领先的多组学服务公司,可提供蛋白质组、修饰组、代谢组等多组学科研检测服务,并且在血液研究领域推出了包括超高深度血液蛋白组、DIA-Ultra定量蛋白组、完整糖肽糖基化修饰蛋白组、Olink精准蛋白组学、QMT1000医学绝对定量靶向代谢组等在内的多款产品。值得一提的是,其中超高深度血液蛋白质组利用拜谱生物自主研发试剂盒富集血液中低丰度蛋白,结合DIA技术及尖端Astral质谱平台,实现了对血液蛋白深度挖掘,鉴定水平已经可达7000+,遥遥领先。欢迎大家咨询!
参考文献:
Niu L, Stinson SE, Holm LA, Lund MAV, Fonvig CE, Cobuccio L, Meisner J, Juel HB, Fadista J, Thiele M, Krag A, Holm JC, Rasmussen S, Hansen T, Mann M. Plasma proteome variation and its genetic determinants in children and adolescents. Nat Genet. 2025 Feb 19. doi: 10.1038/s41588-025-02089-2