

肺癌是全球范围内严重威胁人类健康的恶性肿瘤,其中致癌基因驱动的肺癌占据了相当比例。在过去二十年中,随着临床基因分型、转化研究和药物研发的不断推进,基于致癌驱动基因改变的肺癌分子分层和靶向治疗取得了显著进展,例如针对间变性淋巴瘤激酶(ALK)融合阳性非小细胞肺癌(NSCLC)的酪氨酸激酶抑制剂(TKI)治疗,显著改善了患者的生存状况。然而,肿瘤对靶向治疗的耐药问题逐渐凸显,并且代谢依赖性在治疗敏感性和耐药性中的作用尚不明确。
2025年2月6日美国哈佛医学院在Cell杂志(IF:45.5)上发表了题为“GUK1 activation is a metabolic liabilityin lung cancer”的研究文章,本研究基于酪氨酸磷酸化蛋白组学,量化了肺癌细胞系中972种不同蛋白的1665个酪氨酸磷酸化位点,并深入探究了致癌基因驱动肺癌的代谢脆弱性,发现鸟苷酸激酶1(GUK1)作为GDP合成酶,是ALK信号通路的关键靶点,其激活在肺癌发生发展中起重要作用,为肺癌治疗开辟了新的潜在方向。

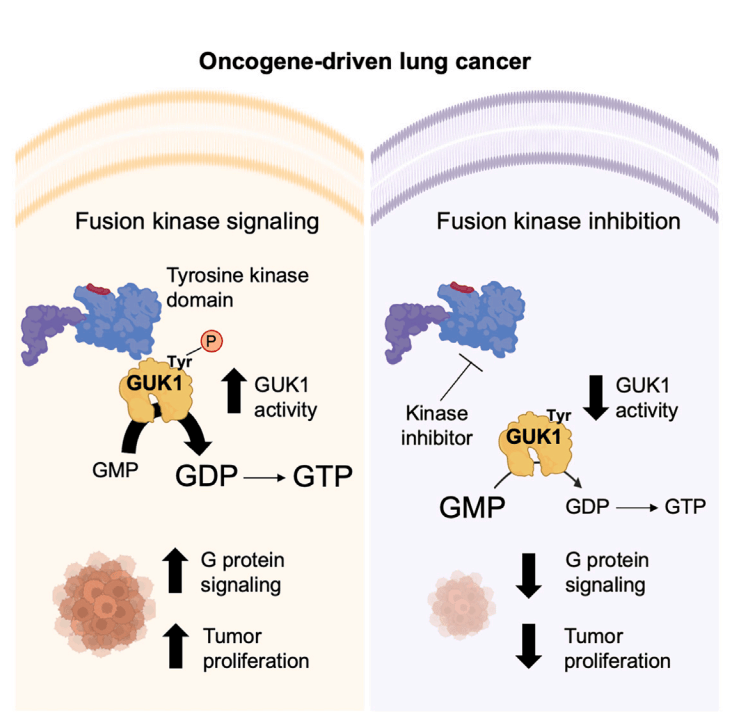 图1 摘要图
图1 摘要图
(图源:Jaime L. Schneider, et al., Cell., 2025)
01、磷酸化蛋白质组学筛选确定GUK1为致癌ALK信号的代谢靶点
为探寻ALK阳性NSCLC对TKI敏感性的细胞机制,对ALK阳性患者来源的细胞系进行了磷酸化蛋白质组学分析。实验选用对第三代ALK TKI劳拉替尼敏感和耐药的细胞系,以及非ALK驱动的肺癌细胞系作为对照,用劳拉替尼处理细胞后,通过免疫沉淀富集酪氨酸磷酸化肽,进行LC-MS分析,以识别潜在的致癌ALK底物。结果共检测到1665个独特的磷酸化位点和972种不同的蛋白质。劳拉替尼处理后,ALK TKI敏感细胞中酪氨酸磷酸化蛋白数量显著减少。进一步将磷酸化蛋白质组数据与蛋白参考列表比对,发现150种蛋白上的239个磷酸化位点受ALK抑制影响,这些靶点在核苷酸代谢途径显著富集。其中,GUK1作为此前未被报道的ALK底物,在ALK阳性细胞系中受ALK抑制的调控程度最高,其74位酪氨酸(Y74)位点在ALK抑制后磷酸化水平显著下降,且该位点在进化上高度保守。图2通过严谨的实验设计和数据分析,首次在肺癌细胞系中确定了GUK1是致癌ALK信号的靶点,为后续研究奠定了基础。
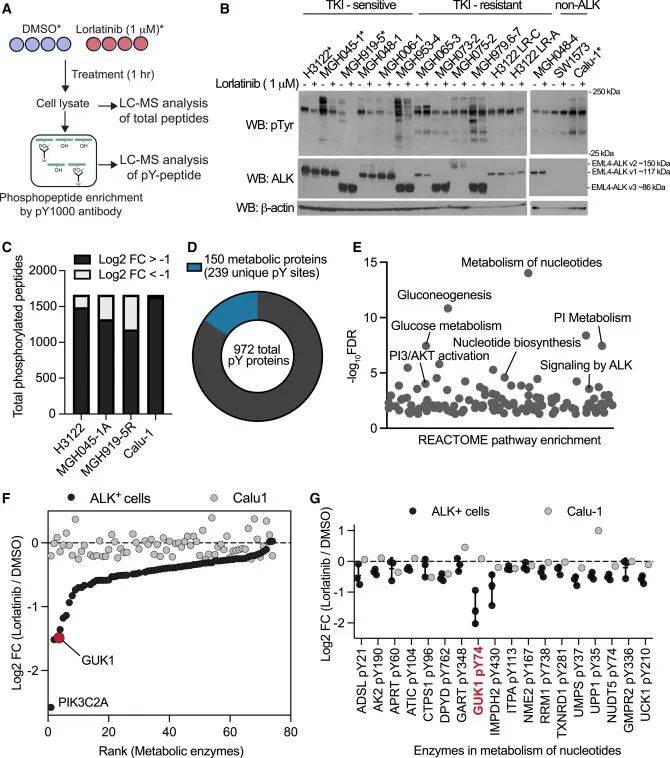 图2 磷酸化蛋白质组学确定GDP合成酶GUK1是致癌ALK的靶标
图2 磷酸化蛋白质组学确定GDP合成酶GUK1是致癌ALK的靶标
(图源:Jaime L. Schneider, et al., Cell., 2025)
02、ALK介导的GUK1在Y74位点的磷酸化增强GDP生物合成
为验证GUK1是否为ALK的直接靶点,研究人员进行了一系列实验。其中体外酪氨酸激酶实验表明,重组ALK蛋白可直接磷酸化GUK1,且该磷酸化作用可被劳拉替尼阻断;体外GUK1酶活性实验显示,磷酸化可增强GUK1的酶活性,劳拉替尼处理则使酶活性逆转。在293T细胞中过表达EML4-ALK融合蛋白,发现GUK1与ALK可共免疫沉淀,且GUK1磷酸化水平和酶活性均升高。通过构建不能磷酸化的GUK1 Y74F突变体,证实Y74是GUK1主要的酪氨酸磷酸化位点,也是其与ALK相互作用的关键位点。分子动力学模拟揭示GUK1在Y74位点磷酸化后,可稳定GMP结合结构域(GMP-BD)的螺旋2,促进GUK1从开放状态转变为有利于底物结合的闭合状态,从而增强GDP形成。此外,定点突变实验确定了GUK1上R65A和R169A突变对其磷酸化、与ALK相互作用及酶活性的影响。综合来说,图3从多个层面详细阐述了ALK介导GUK1磷酸化的机制以及对GDP生物合成的促进作用,为理解GUK1在肺癌代谢中的功能提供了重要依据。
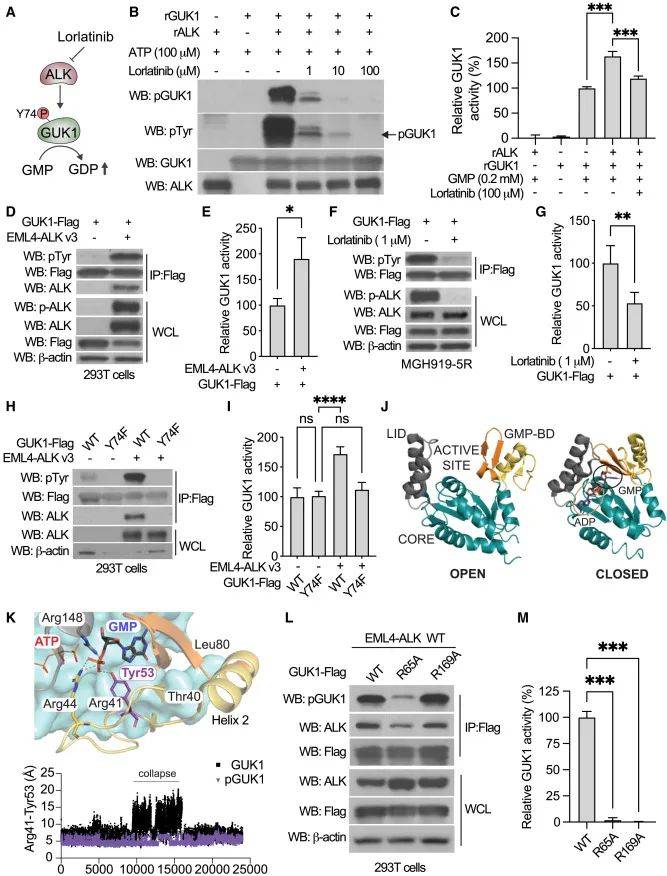 图3 ALK介导的GUK1在Y74位点的磷酸化促进了GDP的生物合成
图3 ALK介导的GUK1在Y74位点的磷酸化促进了GDP的生物合成
(图源:Jaime L. Schneider, et al., Cell., 2025)
03、ALK抑制减少GDP合成
鉴于GUK1在GDP合成中的关键作用,研究人员分析了ALK抑制对嘌呤代谢物水平的影响。图4结果显示用劳拉替尼处理ALK阳性患者来源的细胞系后,细胞内GMP水平升高,GDP和GTP水平降低,嘌呤补救途径中间产物增加,而在Calu-1细胞中无此变化。同位素示踪实验进一步证实,劳拉替尼处理后,ALK阳性细胞中由标记前体合成的GDP和GTP的比例显著下降。同时,过表达EML4-ALK融合蛋白可使细胞内GDP浓度增加。这些结果表明,ALK抑制会阻断GDP和GTP的产生,这与GUK1活性降低一致,明确了ALK-GUK1轴在调控肺癌细胞核苷酸代谢中的重要作用。
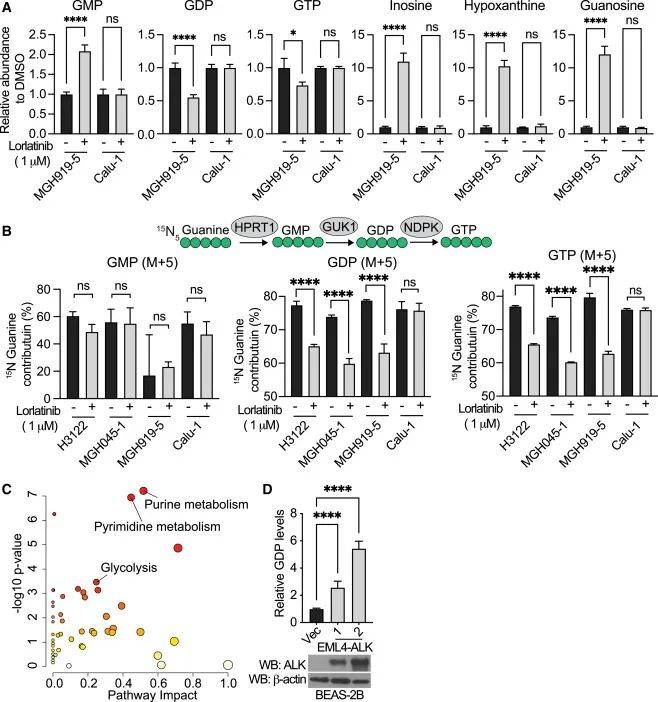 图4 ALK抑制降低GDP合成
图4 ALK抑制降低GDP合成
(图源:Jaime L. Schneider, et al., Cell., 2025)
04、致癌ALK在体内增加鸟嘌呤核苷酸水平
为研究ALK信号在体内对核苷酸代谢的影响,研究人员构建了ALK融合阳性肺癌小鼠模型和传统的KrasG12D/p53-/-(KP)小鼠模型。LC-MS分析显示,ALK驱动的肿瘤中核苷酸代谢途径代谢物富集,GDP水平升高;而KP肿瘤中戊糖磷酸途径和糖酵解相关代谢物富集,GDP水平无显著变化。基质辅助激光解吸电离质谱成像(MALDI MSI)分析发现,ALK阳性小鼠肿瘤中GDP水平高于正常肺组织,且在肿瘤负荷区域变化更为明显;在ALK阳性患者肿瘤活检标本中,同样观察到GDP水平升高,而GMP和GTP水平在非ALK驱动的患者肿瘤中无明显变化。图5的数据结果表明,ALK阳性肿瘤在体内具有较高的GDP水平,且这种升高具有致癌驱动特异性。
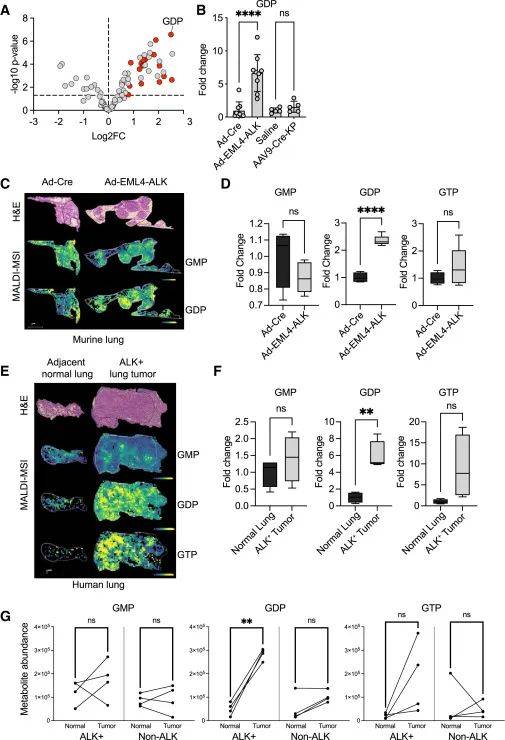 图5 致癌ALK在体内增加鸟嘌呤核苷酸
图5 致癌ALK在体内增加鸟嘌呤核苷酸
(图源:Jaime L. Schneider, et al., Cell., 2025)
05、ALK介导的GUK1磷酸化对肿瘤增殖至关重要
为探究ALK介导的GUK1磷酸化在肿瘤增殖中的作用,研究人员利用CRISPR-Cas9技术敲除ALK阳性肿瘤细胞系中的GUK1,结果导致细胞内GMP水平升高、GDP水平降低,细胞生长减缓。生成识别GUK1 Y74磷酸化位点的特异性抗体后发现,ALK抑制剂可降低pGUK1水平,而EGFR抑制剂无此作用。在缺失内源性GUK1的ALK阳性细胞中分别过表达野生型GUK1(WT GUK1)和Y74F突变体,Y74F突变体表达导致GDP和GTP水平降低,细胞增殖减缓。体内实验显示,WT GUK1表达的肿瘤生长更快,且在劳拉替尼停药后,WT GUK1肿瘤的生长明显快于Y74F GUK1肿瘤。图6的结果表明,ALK介导的GUK1磷酸化对维持肺癌细胞的核苷酸水平和肿瘤生长至关重要,且GUK1磷酸化在TKI停药后的肿瘤复发中起重要作用。
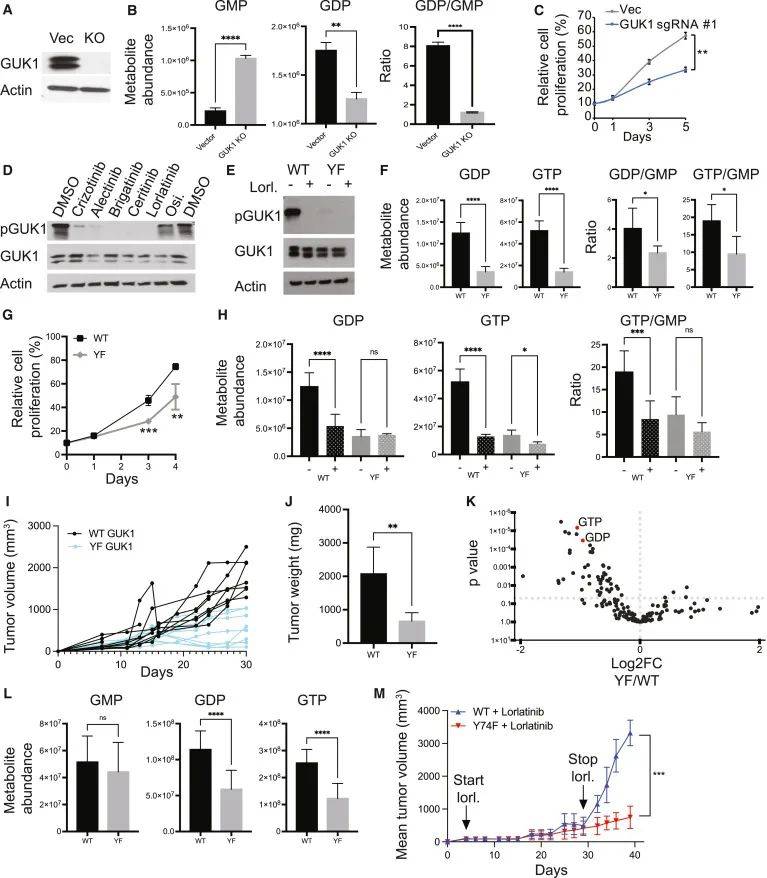 图6 ALK介导的GUK1磷酸化对肿瘤增殖很重要
图6 ALK介导的GUK1磷酸化对肿瘤增殖很重要
(图源:Jaime L. Schneider, et al., Cell., 2025)
06、GUK1磷酸化与ALK阳性患者肿瘤中的GDP在空间上相关并调节MAPK信号通路
为研究ALK介导的GUK1磷酸化与GDP、GTP水平的空间相关性,研究人员开发了一种多重成像方法,将MALDI MSI空间代谢组学分析与pGUK1和ALK的免疫组织化学(IHC)相结合。结果发现,ALK阳性信号和pGUK1阳性蛋白定位与GDP和GTP在体内呈显著正相关,与嘌呤分解产物黄嘌呤呈负相关。此外,研究表明干扰GUK1激活可破坏Ras-GTP结合,降低下游MAPK信号通路中磷酸化MEK和磷酸化ERK的水平。磷酸化蛋白质组学分析还发现GUK1激活可影响包括Rac1在内的其他GTP结合蛋白相关通路。图7这些结果揭示了GUK1通过调节鸟嘌呤核苷酸水平,以非经典方式调控GTP结合蛋白和MAPK信号通路,影响肺癌细胞的增殖和发展。
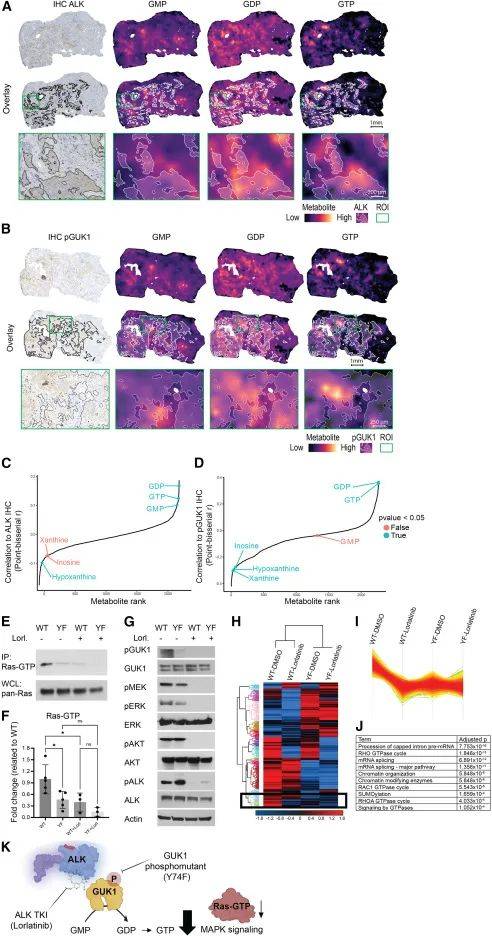 图7 GUK1磷酸化与ALK阳性患者肿瘤中的GDP在空间上相关并调节MAPK信号通路
图7 GUK1磷酸化与ALK阳性患者肿瘤中的GDP在空间上相关并调节MAPK信号通路
(图源:Jaime L. Schneider, et al., Cell., 2025)
07、肺癌中几种致癌融合激酶磷酸化GUK1
如图8所示,除ALK融合外,肺癌中还存在其他可靶向的致癌融合驱动基因,如ROS1和RET。研究发现,ROS1和RET酪氨酸激酶在体外可直接磷酸化GUK1的Y74位点,且其抑制剂可抑制该磷酸化作用。在患者来源的ROS1或RET融合阳性细胞系中,相应抑制剂处理可消除GUK1 Y74位点的磷酸化。通过对肿瘤组织的IHC检测,证实了pGUK1在ROS1或RET融合阳性肺癌患者的肿瘤样本中存在。此外,分析癌症基因组图谱(TCGA)数据发现,GUK1在肺腺癌(LUAD)和肺鳞状细胞癌(LUSC)中的表达和拷贝数增加,且高表达GUK1的患者总体生存率较低。在LUAD 肿瘤微阵列中,部分肺癌标本存在pGUK1阳性信号,提示GUK1磷酸化在肺癌中可能具有更广泛的生物学和治疗相关性。
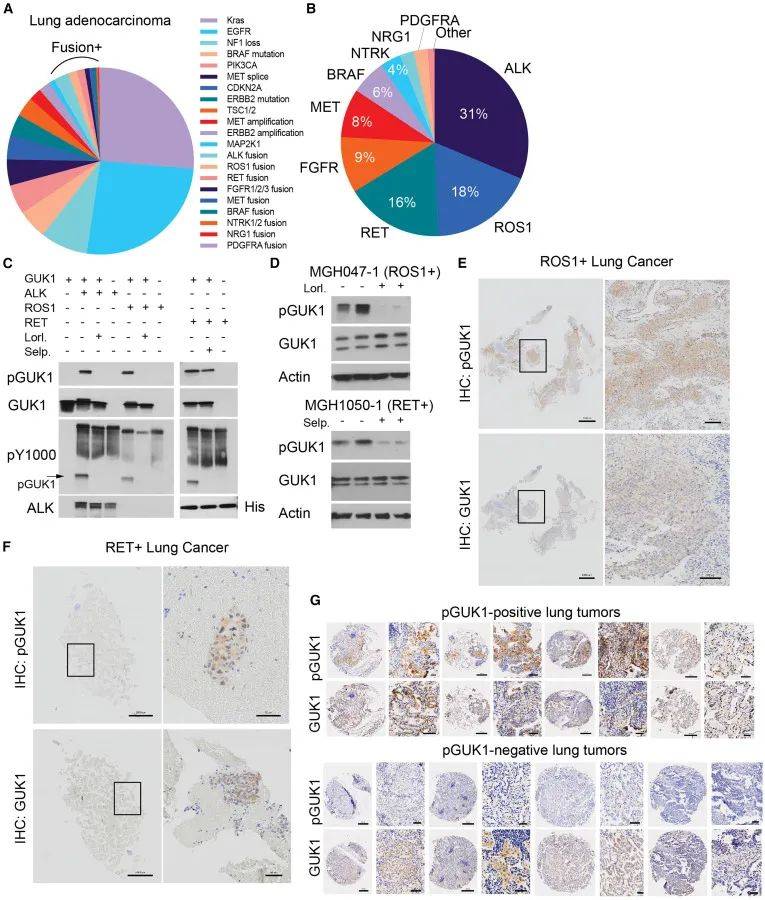 图8 肺癌中的几种致癌融合激酶磷酸化 GUK1
图8 肺癌中的几种致癌融合激酶磷酸化 GUK1
(图源:Jaime L. Schneider, et al., Cell., 2025)
08、小结
本研究通过磷酸化蛋白质组学筛选,首次发现GUK1是致癌ALK信号在肺癌中的重要代谢靶点。ALK介导的GUK1在Y74位点的磷酸化可增强其酶活性,促进GDP生物合成,进而影响细胞内鸟嘌呤核苷酸水平和肿瘤增殖。研究还揭示了GUK1磷酸化通过调节Ras-GTP加载和MAPK信号通路,在肺癌细胞生长中发挥关键作用。此外,除ALK外,ROS1和RET等其他致癌融合蛋白也可调节GUK1磷酸化,且GUK1在多种肺癌分子亚型中均有重要作用。这些发现为深入理解致癌基因驱动肺癌的代谢机制提供了新视角,表明靶向GUK1激活可能是一种有效的肺癌治疗策略,为开发新型治疗方法提供了潜在靶点,有望推动肺癌精准治疗的发展。
09、拜谱小结
拜谱生物作为一家国内领先的多组学服务公司,可提供完善成熟的蛋白质组学、修饰蛋白质组学、代谢组学、转录组学等多组学产品技术服务体系。围绕磷酸化修饰,拜谱生物可提供丝氨酸(Ser)、苏氨酸(Thr)、酪氨酸(Tyr)磷酸化修饰组学检测服务,拜谱特色磷酸化修饰产品—超高深度DIA·磷酸化修饰组,采用创新富集技术+Astral DIA,超高深度赋能低丰度磷酸化蛋白/位点发掘,单针最高可实现动物样本10w+、植物样本5w+磷酸化修饰位点检出,可广泛应用于植物、动物研究,绘制物种磷酸化修饰图谱,助力高分文章发表。此外,磷酸化修饰组学可与蛋白组学、代谢组学等多组学联合,整合多组学数据进行深入挖掘分析,全面解析机制机理等。欢迎咨询!
参考文献:
Schneider JL, Kurmi K, Dai Y, Dhiman I, Joshi S, Gassaway BM, Johnson CW, Jones N, Li Z, Joschko CP, Fujino T, Paulo JA, Yoda S, Baquer G, Ruiz D, Stopka SA, Kelley L, Do A, Mino-Kenudson M, Sequist LV, Lin JJ, Agar NYR, Gygi SP, Haigis KM, Hata AN, Haigis MC. GUK1 activation is a metabolic liability in lung cancer. Cell. 2025 Jan 28:S0092-8674(25)00093-5. doi: 10.1016/j.cell.2025.01.024