

有了血液样本,还在愁怎么发文章吗?血液样本是临床最常见的样本,血液中包含了大量蛋白质、代谢物、免疫细胞,血液分子的动态变化反映了身体健康或疾病状态。因此,我们可以利用血液样本开展与疾病相关的各种研究。蛋白质组学是全局性研究样本中蛋白质定性和定量动态变化的研究利器,为疾病病理和生理研究提供了全面和深入的见解。血液+蛋白质组是医学研究的最常见CP组合,两者的碰撞产生了无数经典的论文,包括生物标志物、疾病预后、感染性疾病机制、蛋白基因组学、血液分泌蛋白质图谱等等。
1、血液蛋白质组相关论文发表情况
今天小编就整理了2024年发表的血液蛋白质组相关论文,看看大家都在研究什么吧。通过在PubMed上用关键词“(plasma OR serum) AND (proteomics) AND (cohort)”进行搜索,我们发现2024发表了约250篇相关论文,其中影响因子大于10分的论文约50篇,从这些论文中我们可以看出血液蛋白质组适用于肿瘤、心血管疾病、神经疾病、感染类疾病等多种疾病的研究。研究方向有:(1)不同类型的生物标志物研究,包括诊断、风险预测、药物应答预测、疾病进程、预后评估等;(2)通过蛋白质数量性状位点(pQTL)、孟德尔随机化等多组学方法进行疾病病因研究和治疗靶点研究;(3)疾病相关血液蛋白质组图谱、特征或景观研究,助力揭示疾病病理生理机制;(4)在随机对照试验中进行药效评估和药效机制研究等。
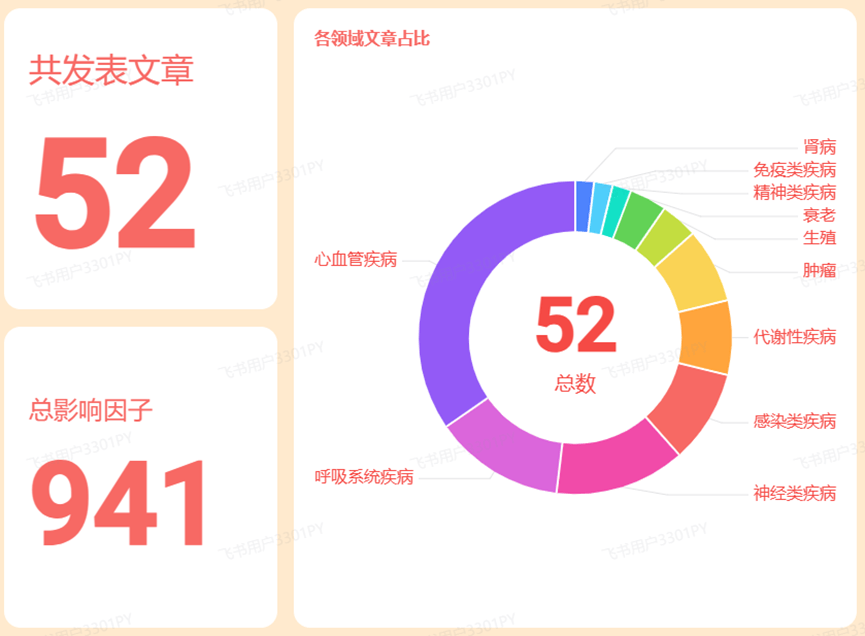 图1 2024年血液蛋白组学相关高分论文
图1 2024年血液蛋白组学相关高分论文
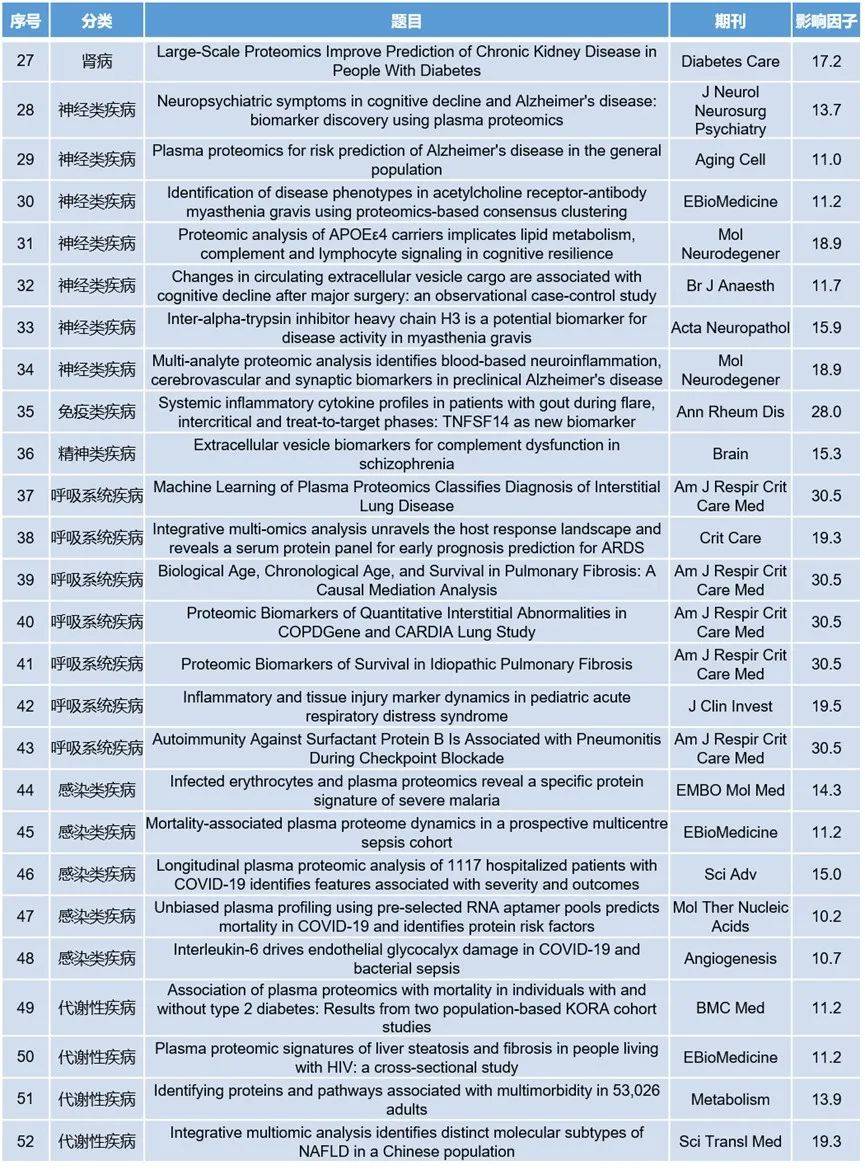
 表1 2024年血液蛋白质组学相关部分高分论文
表1 2024年血液蛋白质组学相关部分高分论文
2、血液蛋白质组检测方法
谈到血液蛋白质组检测技术平台,从过往文献中我们可以看出,应用最多的是三大平台:质谱平台、基于免疫亲和的Olink平台和基于适配体亲和的Somascan平台。质谱是一种非靶向检测方法,随着技术的发展,数据非依赖性采集方法(DIA)凭着高灵敏度和高重复性,已经成为主流技术,代表仪器包括Thermo公司的Obitrap Astral质谱仪和Bruck公司的timsTOF系列质谱仪。Olink和Somascan都是靶向检测方法,优点是技术成熟、灵敏度高,缺点是只能检测已知蛋白、成本高、会有非特异性结合。
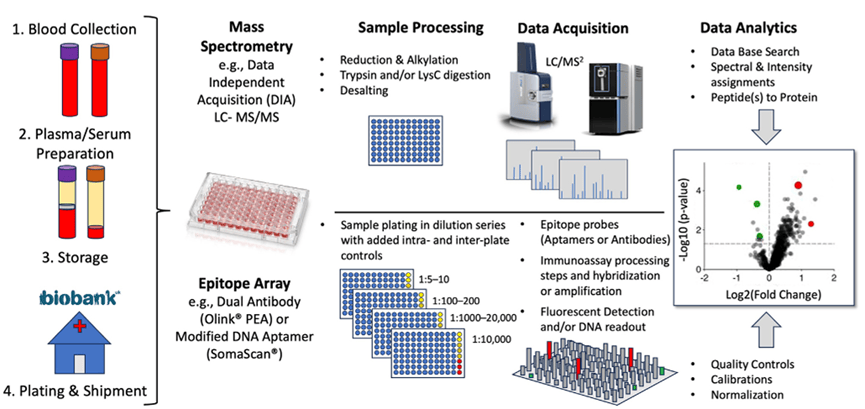 图2 不同血液蛋白质组检测平台的实验流程
图2 不同血液蛋白质组检测平台的实验流程
(图源Sun et al., Mol Cell Proteomics. 2024)
3、血液蛋白质组学研究思路
接下来我们通过几篇经典的论文学习一下血液蛋白质学的研究思路吧。
首先是基于血液蛋白质组学的生物标志物研究,此类研究的关键在于针对临床问题设计合理的研究队列,选择合适的入组人群。如果要筛选早期诊断的标志物,则需要纳入高风险人群;如果研究疾病发生的风险因子,则需要设置前瞻性队列,进行随访;如果研究预后标志物,也需要设置纵向队列;如果研究药物应答标志物,则需要收集用药前基线样本,纳入用药后动态样本还可以分析药物反应机制。
比如复旦大学团队发表在Nature Aging上的“Plasma proteomic profiles predict future dementia in healthy adults”文章就是基于血浆蛋白质组学研究可以预测老年痴呆的生物标志物2。本研究对5万多名UK Biobak中的未发生痴呆的人群进行长达14年的随访,以发生痴呆症状为结局事件,利用基线的血浆蛋白质组数据和机器学习算法筛选预测性标志物。结果发现GFAP、NEFL、GDF15、LTBP2等蛋白与痴呆发生的关联性最强,这几个标志物的组合对老年痴呆的预测AUC值为0.891,而且能提前10年准确预测老年痴呆的发生。

同样是复旦大学团队发表在Nature Communications上的“Plasma proteome profiling reveals dynamic of cholesterol marker after dual blocker therapy”论文则利用蛋白质组研究了肿瘤免疫治疗应答标志物和应答机制3。本研究设置了三个队列,分别是健康队列(n=24),治疗组(n=22,分别在治疗前后不同时间点取样)以及独立验证队列(n=27)。作者基于治疗组纵向队列研究了免疫治疗对血液循环系统的影响以及应答和非应答的差异。通过比较应答和非应答人群的蛋白质组特征筛选了可预测免疫应答的标志物APOC3,并在独立验证队列对APOC3的预测性能进行了验证。

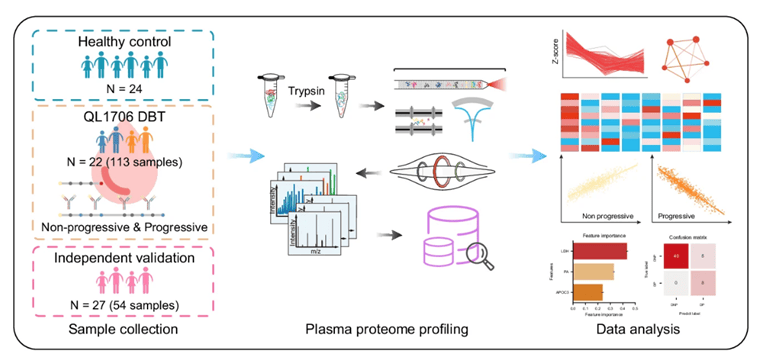 图3 本研究的技术路线
图3 本研究的技术路线
(图源Lyu et al., Nat Commun. 2024)
其次是血液蛋白组结合其它组学如基因组、转录组、代谢组等开展疾病机制和治疗靶点研究。血液蛋白质组与基因组的组合常见于蛋白基因组学研究,一般基于GWAS分析获得蛋白数量性状位点(pQTL),然后再通过全蛋白质组关联分析(PWAS)研究疾病病因和生物标志物。血液蛋白质组与单细胞转录组、代谢组的多组学分析常用于疾病多组学图谱或景观研究,研究疾病的发生机制和生物标志物。
下面这篇文章整合了3000多种血浆蛋白质的前3个最大GWAS数据与可用的pQTL,相应的血液和组织特异性基因表达(mRNA)的最大GWAS,以及慢性肾病相关结局的广泛GWAS。通过全面的分析流程,包括全蛋白质组孟德尔随机化、全转录组孟德尔随机化、共定位分析、蛋白质-蛋白质相互作用(PPI)和基因富集分析,本研究旨在确定潜在的致病蛋白质生物标志物和可用于未来CKD治疗的靶基因4。

西湖大学团队在Nature Communications上发表了“Proteomic landscape of epithelial ovarian cancer”论文5,综合利用组织蛋白质组学和血浆蛋白质组学描绘了上皮性卵巢癌的多病理类型蛋白质组学全景图。文章通过对813名不同病理类型及治疗方案患者的卵巢组织及配对的血浆样本的蛋白质组学分析,鉴定了2551种与上皮性卵巢癌恶性程度相关的蛋白质,其中8种分泌性蛋白在血浆中被验证,可能作为潜在的良恶性鉴别的生物标志物。此外,该研究在术前采集血浆和手术切除组织中分别鉴定了与预后相关的多个蛋白质,通过具有临床转化价值的靶向蛋白质组组学(MRM)验证了他们的预后价值。

4、拜谱小结
血液蛋白质组学研究的流程基本包括研究对象入组、样本制备和蛋白提取、蛋白检测、数据分析。其中样本制备和蛋白提取是非常关键一环,首先要保持方法的一致性,包括样本存储、运输和蛋白提取;其次由于血液中含有大量高丰度蛋白,严重影响质谱检测深度,因此去除高丰度蛋白和富集中低丰度蛋白是十分有必要的。严格的质控是大队列研究数据分析的前提,血液蛋白质组实验一般会通过设置QC样本、添加标准肽内标、剔除偏离蛋白、分析蛋白检出数量等方法对数据进行质控评估。
拜谱生物作为国内领先的多组学公司,可提供完善成熟的蛋白组学、代谢组学、转录组学等多组学产品技术服务体系。针对血液样本,拜谱生物推出了医学大队列血液多组学多维解决方案,可提供超高深度血液蛋白质组、糖蛋白修饰组、血液标志物精准靶向检测、血液代谢组等多组学技术服务,助力“血液-基因-蛋白质-代谢-疾病”多维研究!拜谱生物特色产品超高深度血液蛋白质组系列产品,采用自研血液中低丰度富集试剂盒(BP-MagBeads Kit),结合尖端Orbitrap Astral质谱仪,可实现7000+血液蛋白的检出,深度挖掘血液中低丰度蛋白标志物,是血液蛋白组分析利器。欢迎大家咨询!
参考文献:
[1] Sun BB, Suhre K, Gibson BW. Promises and Challenges of populational Proteomics in Health and Disease. Mol Cell Proteomics. 2024;23(7):100786. doi:10.1016/j.mcpro.2024.100786
[2] Guo Y, You J, Zhang Y, et al. Plasma proteomic profiles predict future dementia in healthy adults. Nat Aging. 2024;4(2):247-260. doi:10.1038/s43587-023-00565-0
[3] Lyu J, Bai L, Li Y, et al. Plasma proteome profiling reveals dynamic of cholesterol marker after dual blocker therapy. Nat Commun. 2024;15(1):3860. Published 2024 May 8. doi:10.1038/s41467-024-47835-y
[4] Si S, Liu H, Xu L, Zhan S. Identification of novel therapeutic targets for chronic kidney disease and kidney function by integrating multi-omics proteome with transcriptome. Genome Med. 2024;16(1):84. Published 2024 Jun 19. doi:10.1186/s13073-024-01356-x
[5] Qian L, Zhu J, Xue Z, et al. Proteomic landscape of epithelial ovarian cancer. Nat Commun. 2024;15(1):6462. Published 2024 Jul 31. doi:10.1038/s41467-024-50786-z