

糖基化修饰是一种重要的蛋白质翻译后修饰过程,指的是低聚糖以糖苷的形式与蛋白质上特定的氨基酸残基共价结合。这种修饰方式在生物体内普遍存在,对蛋白质的结构和功能有着深远的影响。糖基化修饰的研究可以追溯到20世纪,当时科学家们开始认识到蛋白质的功能不仅取决于其氨基酸序列,还受到翻译后修饰的调控。随着人类基因组计划的完成,科学家们发现人类基因的数量并不足以解释生命体的复杂性。因此,蛋白质翻译后修饰,包括糖基化,成为了研究的热点。糖基化修饰的研究不仅揭示了蛋白质功能的多样性和调控机制,还与多种疾病的发生发展密切相关。例如,糖基化异常与帕金森病、风湿性关节炎等疾病有关。此外,糖基化修饰在免疫保护、病毒复制、细胞生长等生物过程中也起着重要作用。因此,糖基化修饰的研究对于深入理解生命现象、揭示疾病机制以及开发新型药物具有重要意义。
2024年糖基化修饰研究进展
在2024年,糖基化修饰研究领域迎来了丰硕的成果,呈现出一批高质量的科研论文。经过我们的统计,共有104篇糖基化研究论文在2024年获得了超过10分的影响因子,这些论文不仅深入探讨了糖基化修饰在免疫、肿瘤、神经疾病等领域的关键作用,还揭示了其在免疫调节、细胞信号传导等多个医学方向的新机制。这些突破性的研究不仅加深了我们对糖基化修饰在生物医学领域中作用的认识,也拓展了我们对其在植物、微生物、食品科学等跨学科领域中影响的理解(图1和表1)。
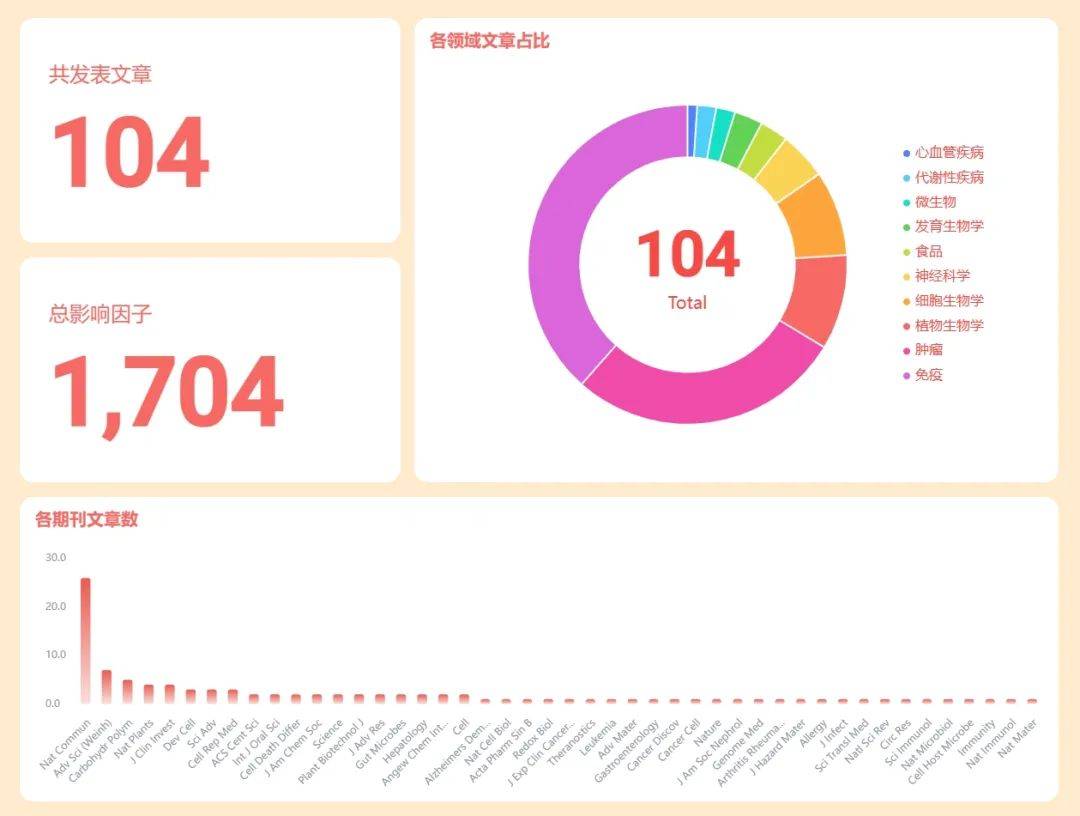 图1 2024年糖基化文章总汇(IF>10)
图1 2024年糖基化文章总汇(IF>10)
表1. 2024年糖基化文章总汇(IF>10)
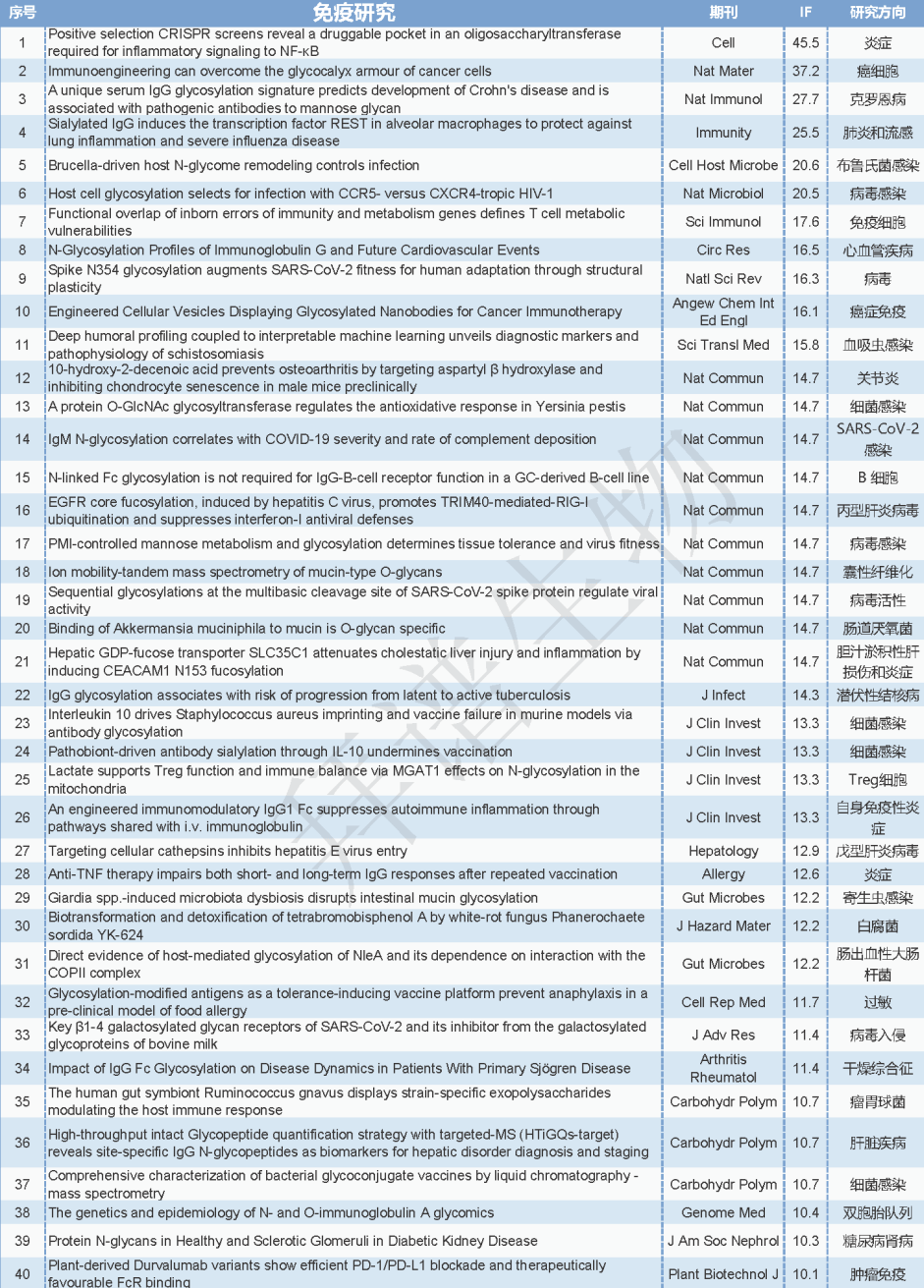
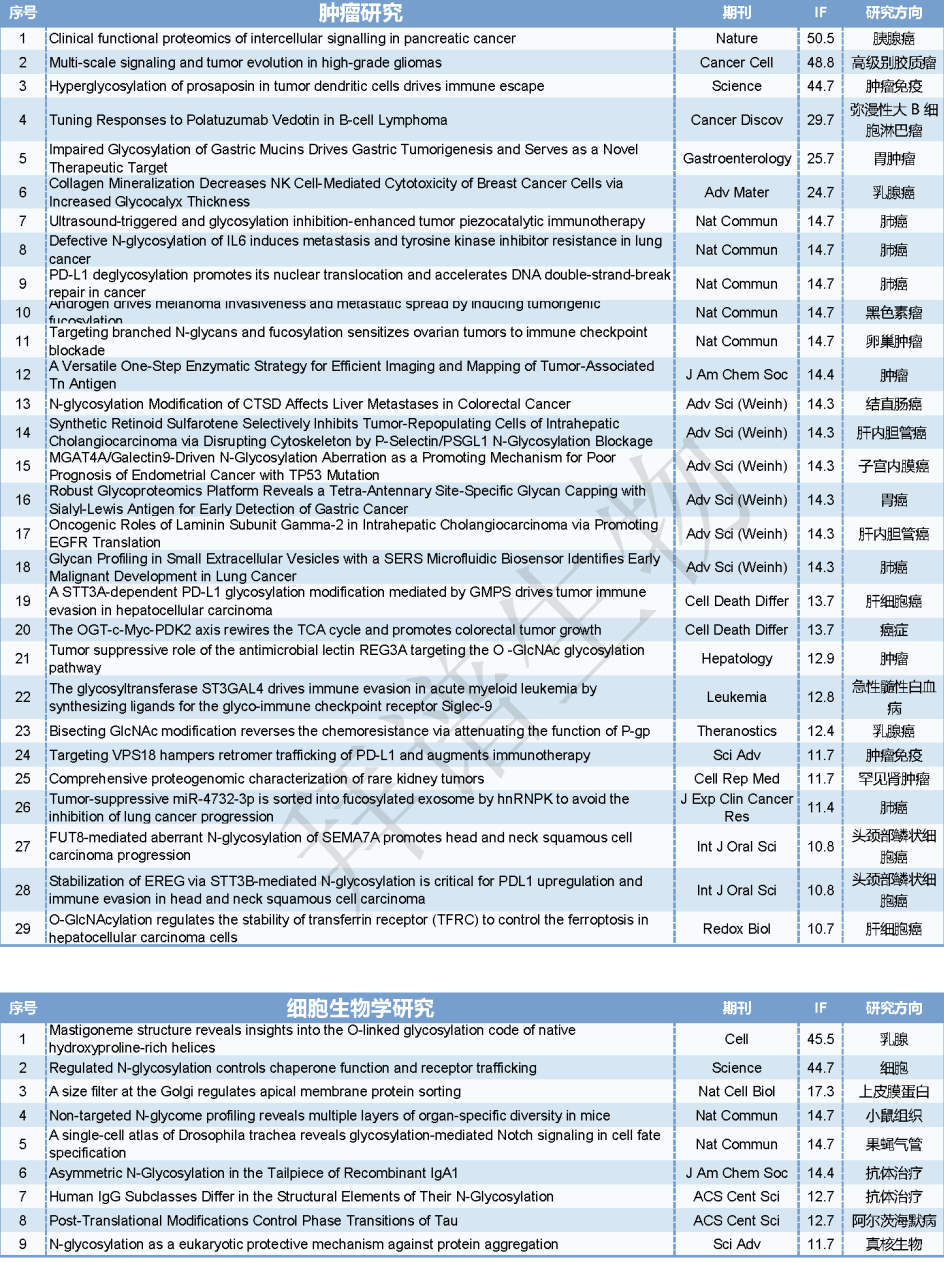
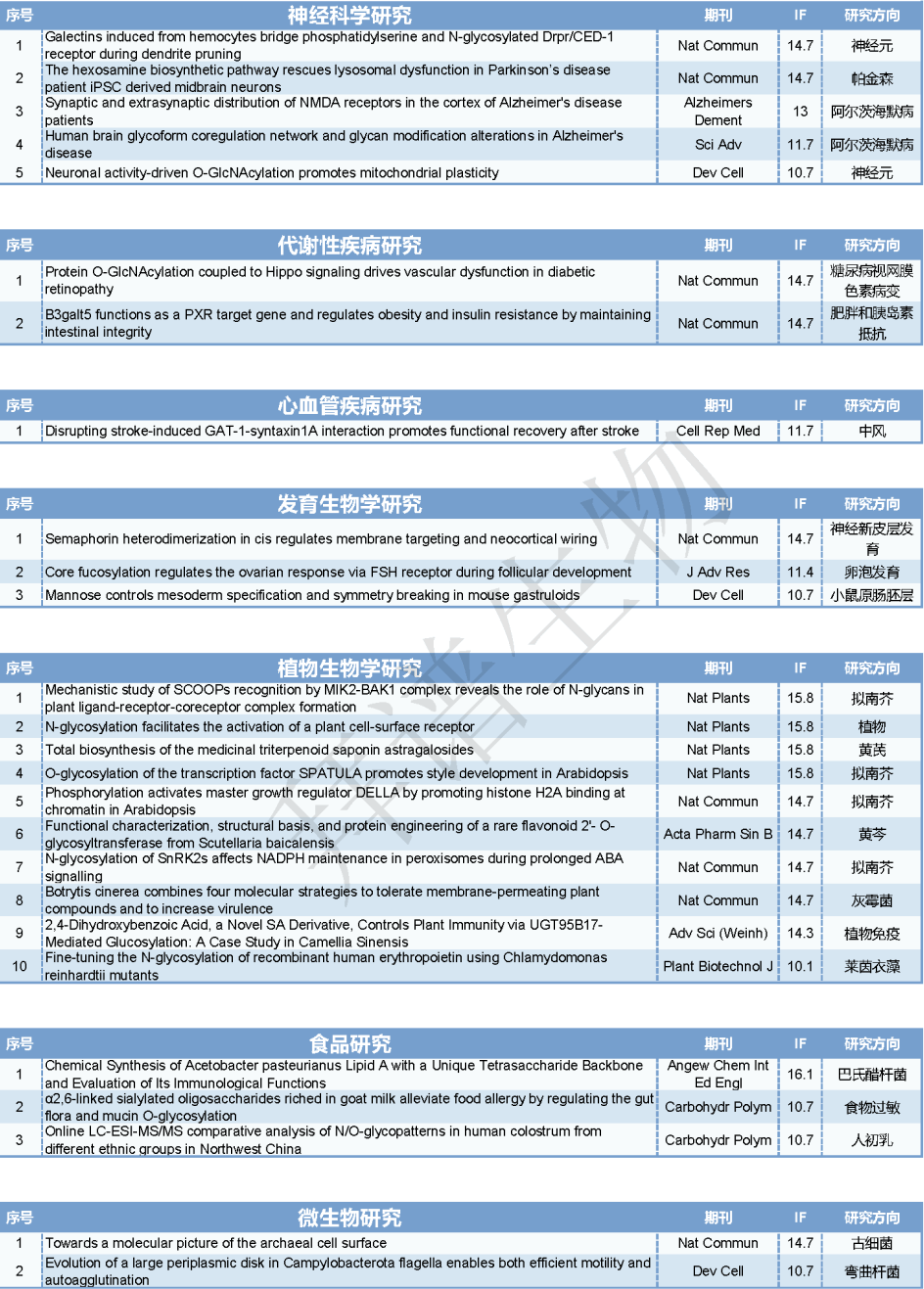
一、研究思路
接下来我们通过几篇经典的文章一起学习一下糖基化修饰组学的研究思路。
01.生物标志物研究
首先是基于糖基化修饰组学的生物标志物研究,关注的是蛋白质糖基化这一翻译后修饰形式在疾病状态下的变化及其作为生物标志物的潜力。对蛋白质的功能和稳定性具有重要影响。在疾病状态下,糖链的模式和水平可能会发生改变,这些改变可以作为生物标志物,用于疾病的诊断、预后评估和治疗效果的监测。根据研究的目的,可以构建不同的研究队列。早期诊断研究聚焦高危人群,前瞻性队列用于识别疾病风险因子,纵向队列分析预后标志物与疾病进程和治疗效果的关系。用药前后的样本收集用于药物应答标志物的研究。通过这些研究,可以系统地发现和验证糖基化修饰组学中的生物标志物,为疾病的诊断、预后评估和治疗提供新的策略和方法。
比如中国科学院大连化学物理研究所发表在Advanced Science上的“Robust Glycoproteomics Platform Reveals a Tetra-Antennary Site-Specific Glycan Capping with Sialyl-Lewis Antigen for Early Detection of Gastric Cancer”文章就是基于糖基化修饰组学研究可以检测早期胃癌生物标志物。本研究成功分析了来自三个队列的278名受试者的血清N-糖蛋白组,并确定了四种具有潜在诊断价值的位点特异性糖基化。其中一种糖基化具有独特的结构,并带有唾液酸Lewis抗原,其诊断早期胃癌的性能显著优于血清CEA。四种标志物的组合能够进一步提高了诊断性能。

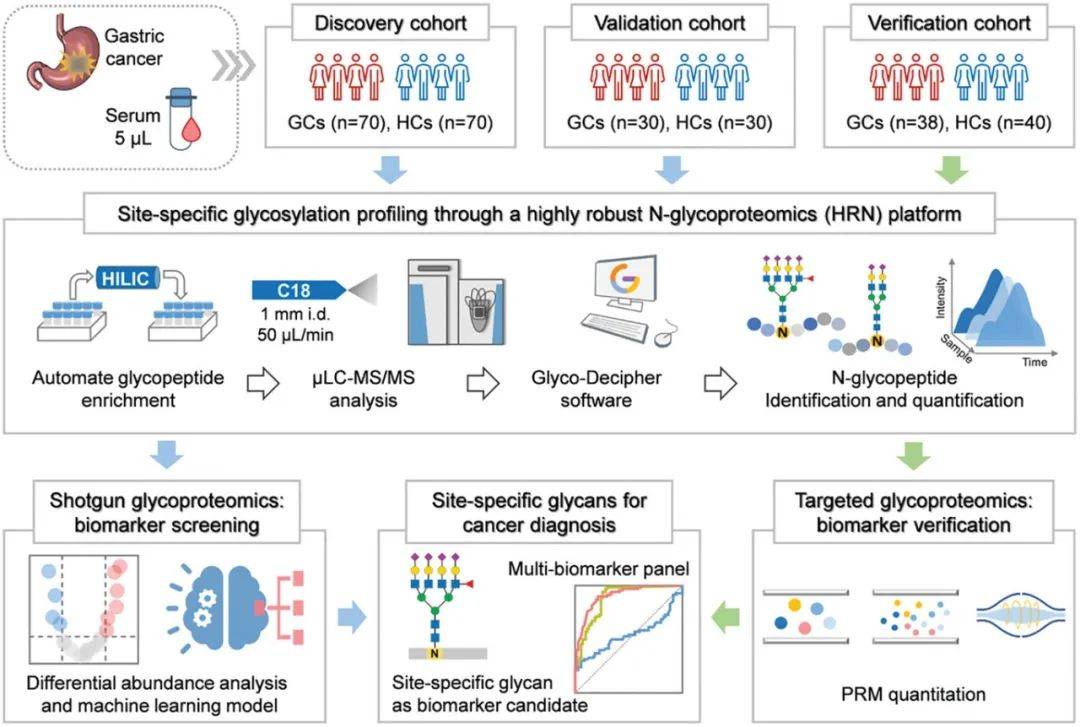 图2 本研究的技术路线
图2 本研究的技术路线
(图源Liu et al., Adv Sci, 2024)
02.机制研究
其次是基于糖基化修饰组学开展疾病机制和治疗靶点研究。糖基化修饰的改变可能影响蛋白质的稳定性、定位、活性和与其他分子的相互作用,从而在疾病的发生和发展中发挥作用。通过研究这些修饰如何改变蛋白质功能,可以更深入地理解疾病的分子机制。在识别出关键的治疗靶点后,可以设计针对这些靶点的药物。例如,抑制异常的糖基化修饰或恢复正常的糖基化修饰可能成为治疗某些疾病的新策略。而且,糖基化修饰可能影响药物与靶点的结合以及药物代谢。
比如斯坦福大学团队发表在Science上的“Regulated N-glycosylation controls chaperone function and receptor trafficking”文章就使用基于完整糖肽组学技术,揭示了内质网中一个调控N-糖基化的新途径,该途径由CCDC134、OST-A和HSP90B1三个蛋白组成。CCDC134与HSP90B1的N端无序肽段结合,并招募OST-A,形成一个保护性的支架,从而抑制HSP90B1的过度糖基化,维持其稳定性和功能。该途径对于WNT信号传导至关重要,其功能障碍会导致骨发育障碍,如骨质疏松症。

我们以本文为例,结合多组学和湿实验,总结一个糖基化研究的整体研究方案,以飨读者。
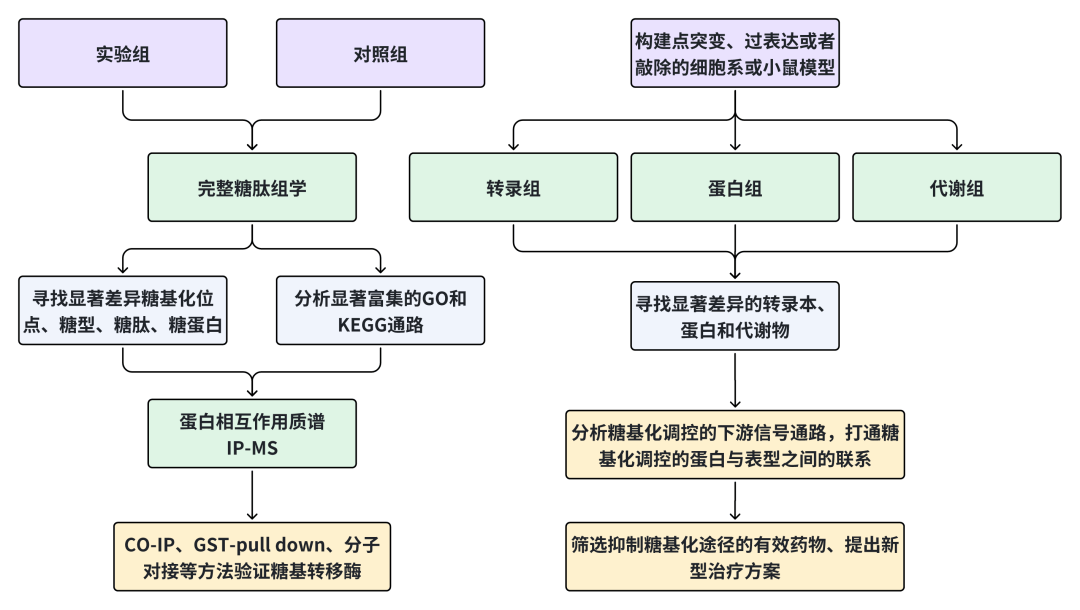 图3 糖基化修饰的机制研究方案
图3 糖基化修饰的机制研究方案
03.修饰图谱
最后是基于糖基化修饰组学的修饰图谱的研究,主要涉及对生物样本中蛋白质的糖基化修饰进行系统性分析,以揭示这些修饰在疾病和生理过程中的作用。通过糖基化修饰组学对检测到的糖基化修饰数据进行整合和分析,构建出翻译后修饰图谱,不仅展示了蛋白质上糖基化修饰的位点、类型和程度,还可以揭示不同样本之间糖基化修饰的差异。通过比较正常样本和疾病样本的糖基化修饰图谱,可以找到与疾病相关的特异性糖基化修饰,为疾病诊断和治疗提供潜在的靶点。此外,结合其他组学数据,如基因组学、转录组学和代谢组学,可以更全面地理解糖基化修饰在生物体内的作用机制。例如,通过分析糖基化修饰与基因表达、蛋白质相互作用和代谢物水平之间的关系,可以揭示糖基化修饰在信号转导、代谢途径和疾病发生中的调控作用。
比如埃默里大学团队发表在Science Advances上的“Human brain glycoform coregulation network and glycan modification alterations in Alzheime’s disease”文章就使用基于完整糖肽组学技术和系统生物学方法,对人类阿尔茨海默病(AD)和对照组的大脑糖蛋白组进行了大规模分析。本研究发现,AD大脑中存在N-糖化形式的改变,包括唾液酸化减少、N-糖分支和延长减少以及甘露糖化增加和N-糖截断增加。网络分析揭示了大脑糖蛋白组的高级组织结构,即核心调控的糖蛋白和糖链网络,并发现了与AD临床表现、β-淀粉样蛋白积累和tau病理相关的糖蛋白和糖链模块。这些发现为理解AD的发病机制提供了宝贵的见解,并为开发基于糖基化的AD疗法和生物标志物开辟了道路。

 图4 本研究的技术路线
图4 本研究的技术路线
二、挑战与机遇
尽管糖基化修饰研究取得了显著进展,但仍面临许多挑战。糖基化修饰的动态性和复杂性使得其研究难度较大,尤其是对于糖链结构的精确鉴定和功能解析。然而,随着新技术的发展,如质谱技术的进步和基因编辑技术的应用,我们有望克服这些挑战。例如,质谱技术的发展使得我们能够精确地鉴定和定量蛋白质上的糖基化位点,这对于理解糖基化修饰的动态变化至关重要。基因编辑技术的应用则为研究特定糖基化修饰的功能提供了新的工具。这些技术的应用不仅加深了我们对糖基化修饰生物学功能的理解,也为疾病治疗提供了新的策略。
三、拜谱小结
糖基化修饰研究的不断深入,不仅推动了基础科学的发展,也为临床应用提供了新的方向。科研人员在这一领域的工作至关重要,他们需要不断开发新的技术和方法,以更好地理解和利用糖基化修饰的生物学功能。未来的研究将继续深入探索糖基化修饰在疾病发生、发展中的作用,以及其在药物开发中的潜在应用。我们期待科研人员能够继续在糖基化修饰领域取得突破,为人类健康带来更多的希望。随着技术的进步和研究的深入,我们有理由相信,糖基化修饰研究将为医学领域带来革命性的变化。
拜谱作为国内领先的多组学服务公司,可提供蛋白组、修饰组、代谢组、转录组等多组学技术服务。拜谱生物建立了N-糖基化修饰组、O-糖基化修饰组、完整糖肽蛋白质组、唾液酸化修饰组的全体系糖蛋白组学服务,其中完整糖肽产品可以同时进行N-糖和O-糖的定量分析,实现糖基化位点、糖型、糖肽和糖蛋白的完整解析,助力深入挖掘糖基化在疾病发生与发展中的应用。欢迎咨询!
参考文献
[1] Liu L, Liu L, Wang Y, Fang Z, Bian Y, Zhang W, Wang Z, Gao X, Zhao C, Tian M, Liu X, Qin H, Guo Z, Liang X, Dong M, Nie Y, Ye M. Robust Glycoproteomics Platform Reveals a Tetra-Antennary Site-Specific Glycan Capping with Sialyl-Lewis Antigen for Early Detection of Gastric Cancer. Adv Sci (Weinh). 2024 Mar;11(9):e2306955. doi: 10.1002/advs.202306955
[2] Ma M, Dubey R, Jen A, Pusapati GV, Singal B, Shishkova E, Overmyer KA, Cormier-Daire V, Fedry J, Aravind L, Coon JJ, Rohatgi R. Regulated N-glycosylation controls chaperone function and receptor trafficking. Science. 2024 Nov 8;386(6722):667-672. doi: 10.1126/science.adp7201
[3] Wang Y, Lei K, Zhao L, Zhang Y. Clinical glycoproteomics: methods and diseases. MedComm (2020). 2024 Oct 4;5(10):e760. doi: 10.1002/mco2.760
[4] Zhang Q, Ma C, Chin LS, Pan S, Li L. Human brain glycoform coregulation network and glycan modification alterations in Alzheimer's disease. Sci Adv. 2024 Apr 5;10(14):eadk6911. doi: 10.1126/sciadv.adk6911