

非小细胞肺癌(NSCLC)是导致癌症相关死亡的最常见原因,在NSCLC的各种病理类型中,肺腺癌(LUAD)已成为主要的类型,尽管LUAD治疗不断取得进展,但疗效仍然微乎其微。因此,确定一个明确的LUAD诊断和预后评估的生物学标志物是至关重要的。
2024年10月1日,苏北人民医院在Cancer Letters(IF=9.1)上发表题为“6-Phosphogluconate dehydrogenase promotes glycolysis and fatty acid synthesis by inhibiting the AMPK pathway in lung adenocarcinoma cells”的研究文章。本文研究表明,PGD在LUAD中上调,并抑制AMPK通路,从而增强糖酵解和脂肪酸合成,促进肿瘤的恶性进展。因此,靶向PGD是治疗LUAD的一种潜在的治疗策略。该研究成果中拜谱生物为其提供蛋白互作组的检测与分析。

文章名称:6-Phosphogluconate dehydrogenase promotes glycolysis and fatty acid synthesis by inhibiting the AMPK pathway in lung adenocarcinoma cells(Cancer Letters,IF=9.1,2024.10)
客户单位:苏北人民医院
研究材料:IP beads
拜谱提供技术:蛋白互作组分析
技术路线:
研究结果
磷酸戊糖途径(PPP)在LUAD中被显著激活
从6例LUAD患者中收集了1份正常组织样本和12份肿瘤组织样本进行单细胞RNA测序,注释有T细胞、髓系细胞、上皮细胞、B细胞、内皮细胞、成纤维细胞和肥大细胞(图1A-C),其中上皮细胞,分为15个簇,根据CNV(拷贝数变异)将其分为正常类别和肿瘤类别(图1D-F)。在恶性上皮细胞亚群内,PPP中的基因显著上调(图1G),且在上皮细胞从良性状态向恶性状态转变的过程中,PPP中限速酶(PGD、G6PD、TALDO1和TKT)的表达水平逐渐升高(图1H-I)。这些发现表明,PPP在LUAD的肿瘤发生和发展中起着关键作用。
 图1 磷酸戊糖途径(PPP)在LUAD中被显著激活
图1 磷酸戊糖途径(PPP)在LUAD中被显著激活
(图源:Jun Wu., et al., Cancer Lett., 2024)
PGD在LUAD中高表达,并与不良预后相关
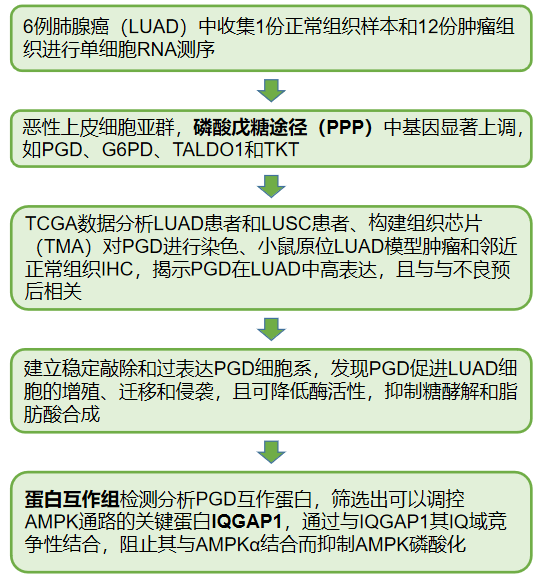
分析568例LUAD患者和545例LUSC患者的TCGA数据,发现PPP在LUSC和LUAD样本中显著富集(图2A-B),且四种限速酶(PGD、G6PD、TALDO1和TKT)的表达均显著升高(图2C),在LUAD患者中,PGD的高表达与不良预后相关。
构建组织芯片(TMA)对PGD进行染色,证实:在LUAD和LUSC患者的癌变组织中,PGD的表达量高于配对的正常组织。小鼠原位LUAD模型肿瘤和邻近正常组织IHC结果进一步证明,揭示PGD可能作为LUAD的致癌基因,加速LUAD的进展(图2I)。
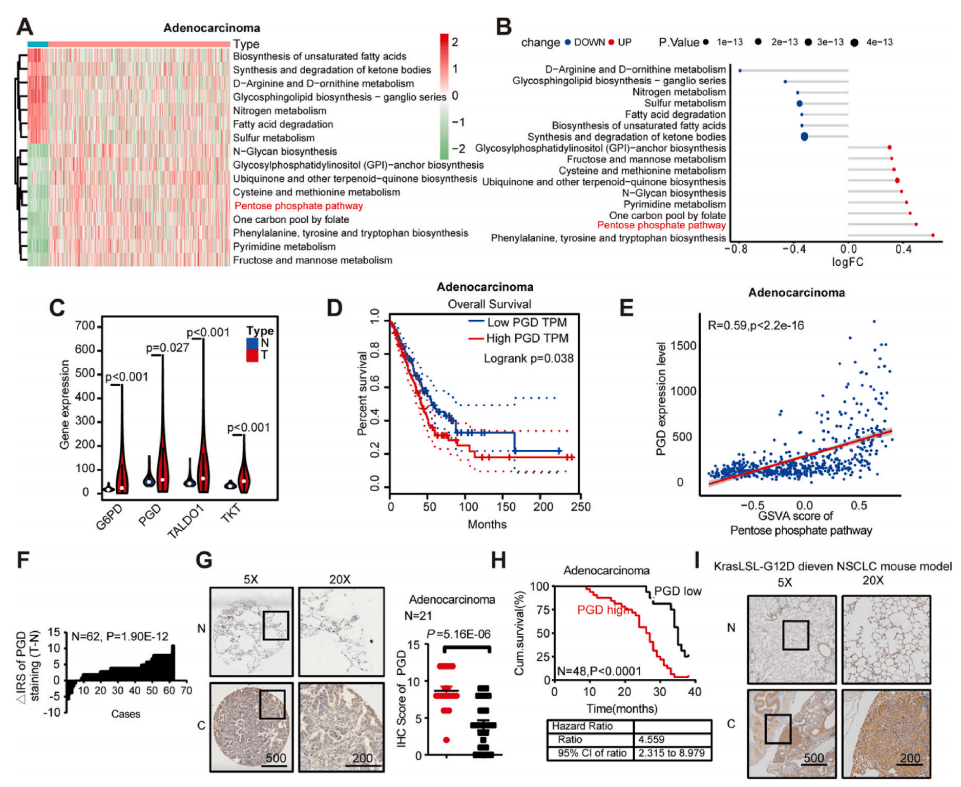 图2 PGD在LUAD中高表达,并与不良预后相关
图2 PGD在LUAD中高表达,并与不良预后相关
图源:Jun Wu., et al., Cancer Lett., 2024)
PGD促进LUAD细胞的增殖、迁移和侵袭
LUAD细胞中PGD的蛋白水平高于人正常肺支气管上皮细胞。构建敲除和过表达PGD细胞系,CCK-8证明PGD促进LUAD细胞增殖(图A-D),体外迁移和侵袭实验证明PGD促进LUAD细胞转移(图3F-G);
PGD抑制剂处理LUAD细胞,细胞活力剂量依赖性下降(图3H),且抑制其集落形成(图3I),降低其迁移和侵袭能力(图3K-L)。动物实验中也证实,敲除PGD显著抑制肿瘤生长(图3M-P)。
 图3 PGD促进LUAD细胞的增殖、迁移和侵袭
图3 PGD促进LUAD细胞的增殖、迁移和侵袭
(图源:Jun Wu., et al., Cancer Lett., 2024)
抑制PGD可降低酶活性,抑制糖酵解和脂肪酸合成
PGD敲除或抑制剂处理,降低细胞NADPH/NADP+比值(图4D),增加ROS水平(图4A-C)。KEGG发现PGD-high细胞在脂肪细胞因子信号通路和糖酵解通路中显著富集(图4E)。且敲除PGD显著抑制了乳酸的产生,降低糖酵解能力(图4F-G),Oil Red O染色显示,PGD显著促进了细胞的脂质积累(图4H)。这些发现提示PGD可能促进糖酵解和脂质代谢来驱动LUAD的进展。
 图4 抑制PGD可降低酶活性,抑制糖酵解和脂肪酸合成
图4 抑制PGD可降低酶活性,抑制糖酵解和脂肪酸合成
(图源:Jun Wu., et al., Cancer Lett., 2024)
PGD通过与IQGAP1竞争性地相互作用来抑制AMPK通路的激活
抑制PGD,LUAD细胞中的p-AMPK水平显著升高(图5A),利用蛋白互作组检测PGD互作蛋白(图5B-C),从中筛选出可以调控AMPK通路的关键蛋白IQGAP1(图5D),co-IP、免疫荧光染色证实了PGD与IQGAP1相互作用(图5E-G)。且发现PGD通过与IQGAP1其IQ域竞争性结合,阻止其与AMPKα结合而抑制AMPK磷酸化(图5H-J)。
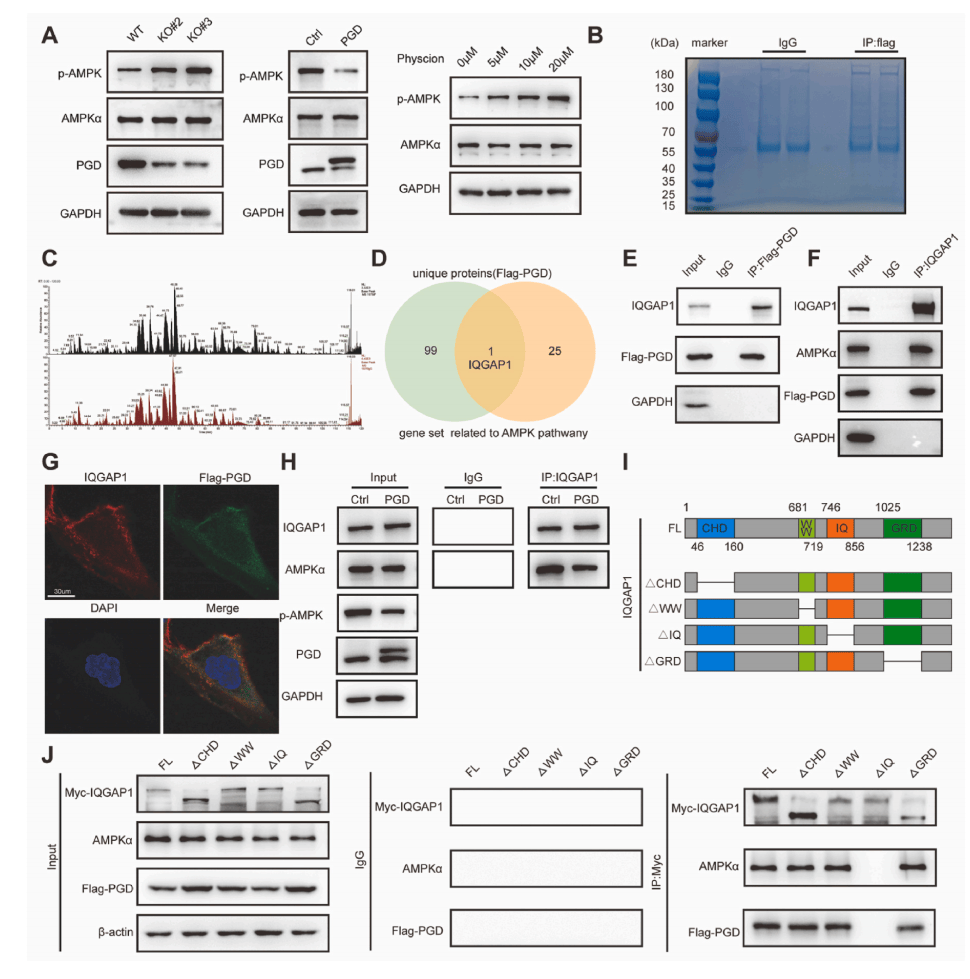 图5 PGD通过与IQGAP1竞争性地相互作用来抑制AMPK通路的激活
图5 PGD通过与IQGAP1竞争性地相互作用来抑制AMPK通路的激活
(图源:Jun Wu., et al., Cancer Lett., 2024)
抑制AMPK通路可以恢复PGD敲除诱导的抗癌作用
敲除PGD能抑制LUAD细胞的增殖、迁移和侵袭,这种作用能被AMPK抑制剂逆转(图6A-D),而且敲除PGD所抑制糖酵解和脂肪酸合成,同样能被AMPK抑制剂逆转(图6E-H)。
 图6 抑制AMPK通路可以恢复PGD敲除诱导的抗癌作用
图6 抑制AMPK通路可以恢复PGD敲除诱导的抗癌作用
(图源:Jun Wu., et al., Cancer Lett., 2024)
PGD具有作为一种新的、有效的LUAD治疗靶点的潜力
PGD特异性抑制剂与二甲双胍联合使用对体外肿瘤生长有协同抑制作用(图7B),且在肿瘤异种移植研究中得到证实(图7C-E)。另外该组合表现出最显著的AMPK通路激活(图7F),综上所述,PGD及其下游AMPK通路是治疗LUAD的潜在新靶点。
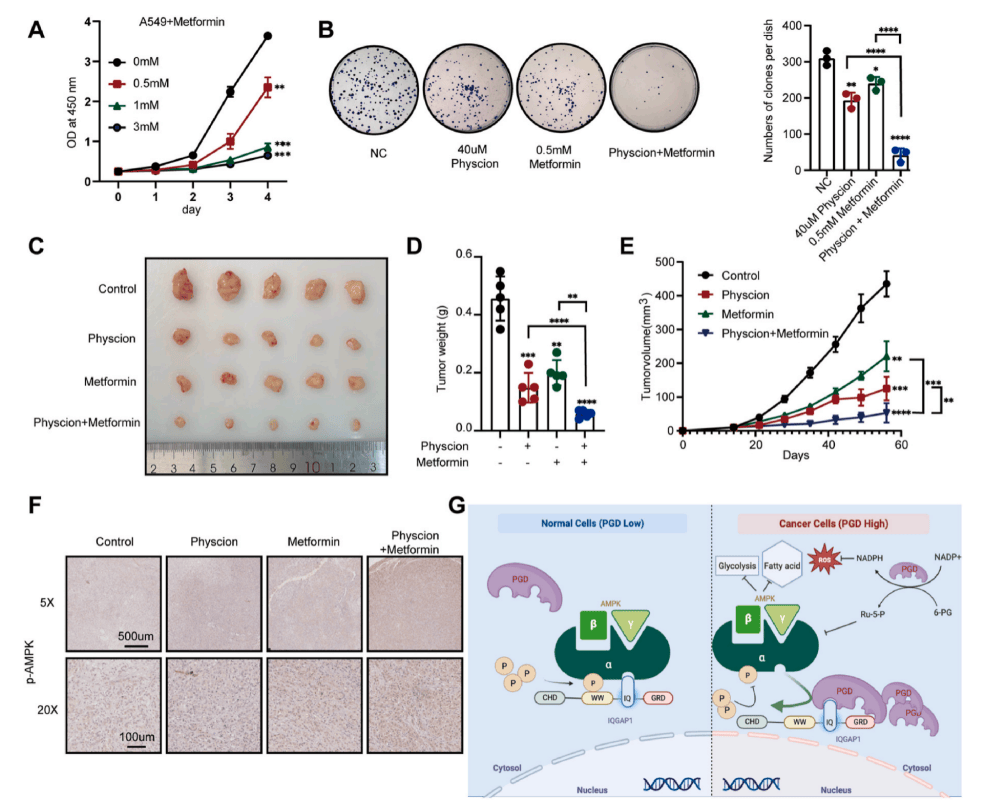 图7 PGD具有作为一种新的、有效的LUAD治疗靶点的潜力
图7 PGD具有作为一种新的、有效的LUAD治疗靶点的潜力
(图源:Jun Wu., et al., Cancer Lett., 2024)
文章小结
异常代谢已成为癌症的一个显著特征,在肺腺癌(LUAD)的发生和发展中起着关键作用。在这项研究中,单细胞测序揭示,在恶性上皮细胞亚群的恶性进展过程中,代谢酶6-磷酸葡萄糖酸脱氢酶(PGD)显著上调;体外和体内分析发现,PGD敲除或抑制其活性可抑制LUAD细胞的增殖、迁移和侵袭;TCGA数据库分析和LUAD组织芯片数据发现PGD上升,并且与LUAD患者的不良预后密切相关,可作为潜在治疗靶点。
拜谱小结
研究首次揭示肺腺癌中IQGAP1是PGD的强有力的新型相互作用蛋白。PGD通过与已知的AMPKα结合伴侣IQGAP1的IQ域竞争性相互作用,降低了p-AMPK的水平,从而促进了LUAD细胞的糖酵解和脂肪酸合成。该研究成果中拜谱生物为其提供蛋白互作组的检测与分析。拜谱生物已研发完成并建立了完善成熟的转录组学、蛋白组学、代谢组学以及多组学联合产品技术服务体系,欢迎致电咨询!
参考文献:
Wu J, Chen Y, Zou H, Xu K, Hou J, Wang M, Tian S, Gao M, Ren Q, Sun C, Lu S, Wang Q, Shu Y, Wang S, Wang X. 6-Phosphogluconate dehydrogenase promotes glycolysis and fatty acid synthesis by inhibiting the AMPK pathway in lung adenocarcinoma cells. Cancer Lett. 2024 Oct 1;601:217177. doi: 10.1016/j.canlet.2024.217177