

什么是棕榈酰化修饰蛋白组?
蛋白质是生命的物质基础,蛋白质要经过基因转录、转录后加工、翻译、翻译后加工及转运等多个复杂过程后才具有生理功能。蛋白质的翻译后加工修饰形式包括磷酸化、糖基化、甲基化、羟基化、泛素化及脂质化等,其中脂质化修饰是一种重要的翻译后加工修饰形式,而N-豆蔻酰化和棕榈酰化是重要的脂质化修饰形式。
蛋白质棕榈酰化修饰一般发生在半胱氨酸残基上,依据其连接方式可以分为S-棕榈酰化、N-棕榈酰化和O-棕榈酰化。N-棕榈酰化是棕榈酰基与甘氨酸/半胱氨酸(Gly/Cys)残基通过酰胺键连接,因酰胺键较稳定,因此不可逆;O-棕榈酰化是棕榈酰基通过酯键与丝氨酸残基相连;S-棕榈酰化是指含有16 个碳原子的饱和棕榈酸和半胱氨酸(Cys)共价结合,形成不稳定的硫酯键,这种棕榈酰化具有可逆性,可在时间和空间上调节蛋白质的功能,因此它是最重要的一种棕榈酰化修饰方式。
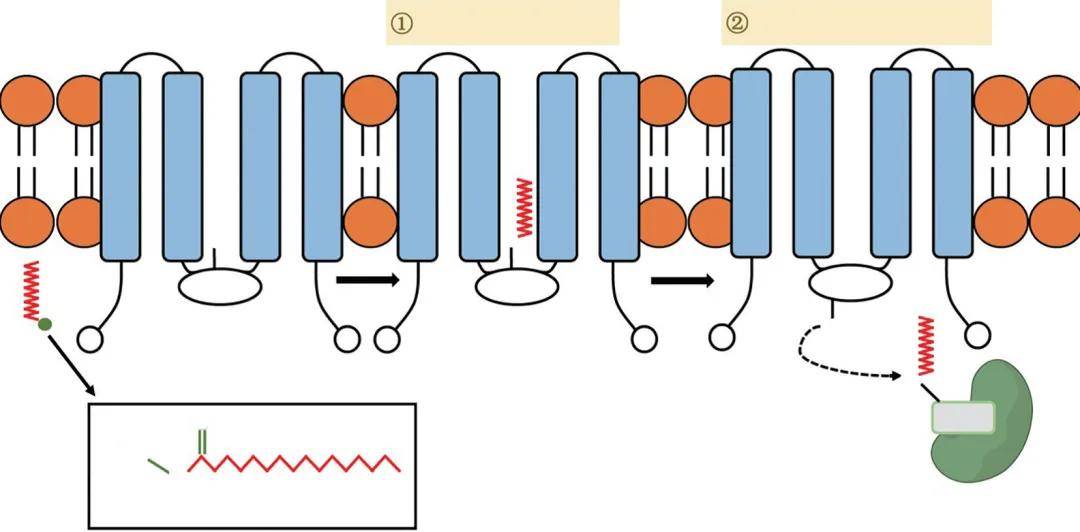
蛋白质S-棕榈酰化修饰包括两个过程,第一步发生自酰化,棕榈酰CoA和棕榈酰基转移酶的半胱氨酸通过硫酯键相连,形成酰基酶中间体,并释放游离的CoA-SH。在没有底物时,该中间体会被缓慢地水解;第二步当存在底物时,会将中间体连接的棕榈酰基转移至底物半胱氨酸上(见下图)。
该技术能触达的特定场景有哪些?
1)棕榈酰化修饰最重要的功能是增强可通行蛋白与膜的亲和性,从而调控蛋白质的定位与功能,因而棕榈酰化修饰蛋白组学可用于研究蛋白质的转运及定位;
2)蛋白质棕榈酰化修饰广泛存在于神经系统中,蛋白质棕榈酰化在神经系统的发生率高于其他组织器官。多数含有半胱氨酸的神经元蛋白易受到棕榈酸的影响,如神经递质受体、突触支架蛋白和分泌信号分子等。棕榈酰化蛋白质组学可用于研究神经精神疾病的发生机制和发展机理;
3)在病毒感染宿主的过程中,S-棕榈酰化修饰不仅参与病毒自身的复制与感染,同时也参与调控病毒感染诱导的抗病毒天然免疫信号通路,因而棕榈酰化蛋白质组学分析可以研究病毒感染机制及宿主的抗病毒机制;
4)越来越多的蛋白可被棕榈酰化修饰,其中多种都与癌症相关,例如乳腺癌,小细胞肺癌,黑色素瘤,白血病,宫颈癌和卵巢癌,因而棕榈酰化蛋白质组学分析可以用于研究癌症的发生机制和癌症治疗靶点。
5)钙依赖性蛋白激酶(CPKs)是与非生物胁迫信号相关的钙敏感激酶,在其N末端的半胱氨酸残基被S-棕榈酰化,研究表明棕榈酰化对于调节与干旱胁迫相关的蛋白质的活性至关重要,因而通过棕榈酰化修饰蛋白质组学分析可以研究植物的非生物胁迫应答机制。
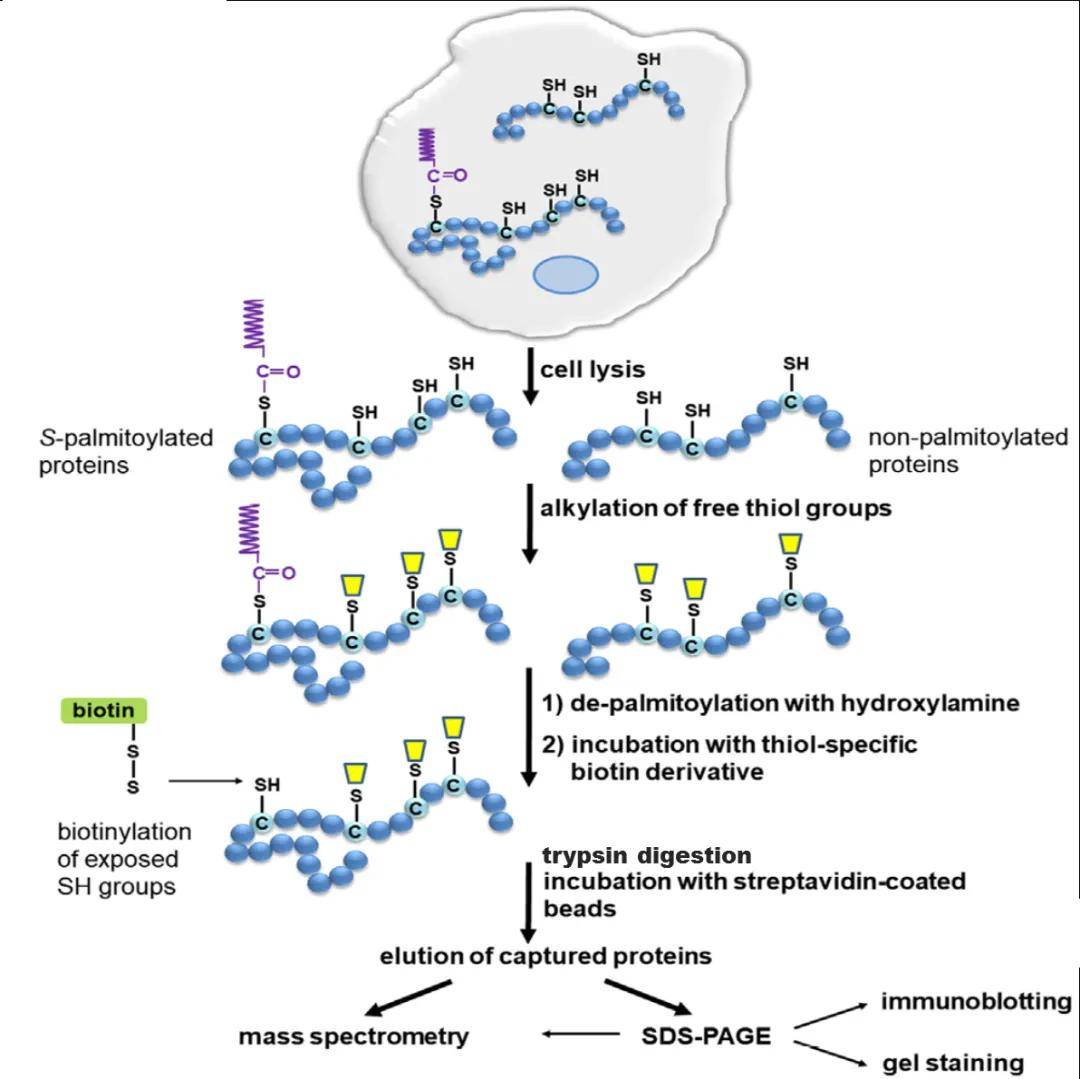
基于质谱的技术路线:
技术难点:
1)蛋白水平富集特异性不好,蛋白质水平富集的修饰蛋白质中仍有大量肽段是非修饰的,蛋白质水平的富集是基于蛋白质的高级结构,如果修饰发生在蛋白质构象内部,会影响富集效果;
2)柱上酶解效率不高,胰蛋白酶不能有效接触蛋白质,降低了酶解效率。
实际应用的文献参考:
[1] Main A, Fuller W. Protein S‐Palmitoylation: Advances and Challenges in Studying a Therapeutically Important Lipid Modification[J]. The FEBS Journal, 2021.
[2] Hornemann T. Palmitoylation and depalmitoylation defects[J]. Journal of Inherited Metabolic Disease, 2015,38(1): 179-186.
[3] Vats G, Grover M, Singh A, Chandra N, Pandey N, Rai A. Role of palmitoylation and nitration in modification of large number of proteins associated with drought stress in plants[J]. Agrica, 2016,5(1): 59-62.
[4] Ohn T, Anderson P. The role of posttranslational modifications in the assembly of stress granules[J]. Wiley Interdisciplinary Reviews-RNA 2010,1(3): 486-493.
[5] Singh A, Vats G, Chandra N, Grover M. Sumoylation may play an important role in modification of large number of proteins associated with heat stress in plants[J]. Proceedings of the National Academy of Sciences India, 2014,84(3): 709-712.
[6] Zareba-Koziol M, Bartkowiak-Kaczmarek A, Figiel I, et al. Stress-induced changes in the S-palmitoylation and S-nitrosylation of synaptic proteins[J]. Molecular & Cellular Proteomics, 2019, 18(10): 1916-1938.
[7] Globa A K, Bamji S X. Protein palmitoylation in the development and plasticity of neuronal connections[J]. Current opinion in neurobiology, 2017, 45: 210-220.
[8] Anderson A M, Ragan M A. Palmitoylation: a protein S-acylation with implications for breast cancer[J]. NPJ Breast Cancer, 2016, 2(1): 1-10.
[9] Zhang M M, Hang H C. Protein S-palmitoylation in cellular differentiation[J]. Biochemical Society Transactions, 2017, 45(1): 275-285.