

蛋白质中的半胱氨酸(Cys)残基富含亲核硫原子,是一个极其活跃的氨基酸残基,不仅经常参与酶反应,还可使半胱氨酸发生广泛的翻译后修饰(PTM),这些修饰导致一系列生化反应并调节各种生理和病理过程,例如自噬、蛋白质稳定、氧化还原稳态和细胞信号传导,并且研究发现半胱氨酸PTM与许多人类疾病密切相关,比如癌症、糖尿病等。对半胱氨酸PTM位点的鉴定与分析是探索其在生物活动中的功能作用的基础,但是,由于修饰水平低及修饰状态的动态变化,使得在蛋白质组学水平上直接检测半胱氨酸PTM具有很大的挑战性。
基于此,拜谱生物专业研发团队经过反复实验,创新研发出棕榈酰化(独家)、亚硝基化、谷胱甘肽化、氧化还原修饰蛋白质组学技术,半胱氨酸巯基化、次磺酸化修饰组学也在研发中。拜谱生物特色组学技术采用生物素交换法,能够更特异的结合修饰基团,大幅度提升修饰位点鉴定数目,并且进一步优化富集效率,提高半胱氨酸巯基稳定性,以提升低丰度修饰位点定量准确性,助力剖析半胱氨酸修饰的分子机制和调控作用,解析疾病相关分子机制等。
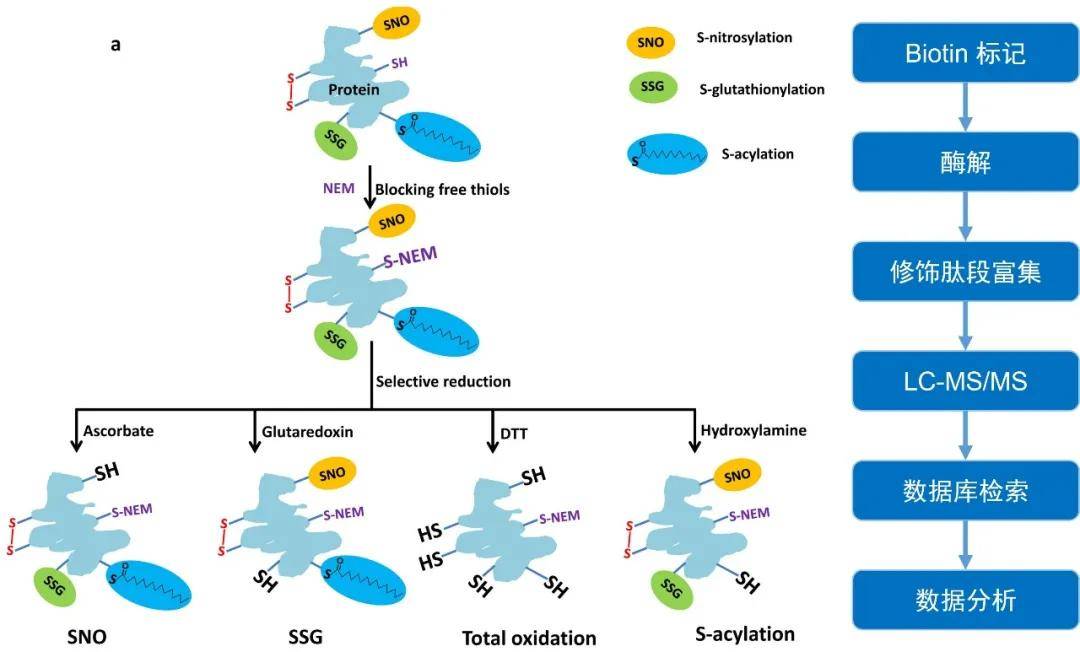 拜谱生物棕榈酰化、亚硝基化、氧化还原修饰组学技术路线
拜谱生物棕榈酰化、亚硝基化、氧化还原修饰组学技术路线
(图片再编辑,源自:Guo J, et al, Nat Protoc, 2014)
项目经验
拜谱生物在棕榈酰化、亚硝基化、氧化还原修饰组学方面拥有丰富的服务经验,修饰位点鉴定量普遍在8000以上,棕榈酰化修饰位点鉴定量更是突破20000+,比如在人源卵巢组织中鉴定到21051个棕榈酰化修饰位点,人源细胞中鉴定到20794个棕榈酰化修饰位点;白菜的亚硝基化修饰位点鉴定量也能达到9000+。
 拜谱生物棕榈酰化、亚硝基化、氧化还原修饰组学部分项目数据
拜谱生物棕榈酰化、亚硝基化、氧化还原修饰组学部分项目数据
送样建议
拜谱生物棕榈酰化、亚硝基化、氧化还原修饰组学可广泛应用于动、植物研究中,具体送样建议见下表。
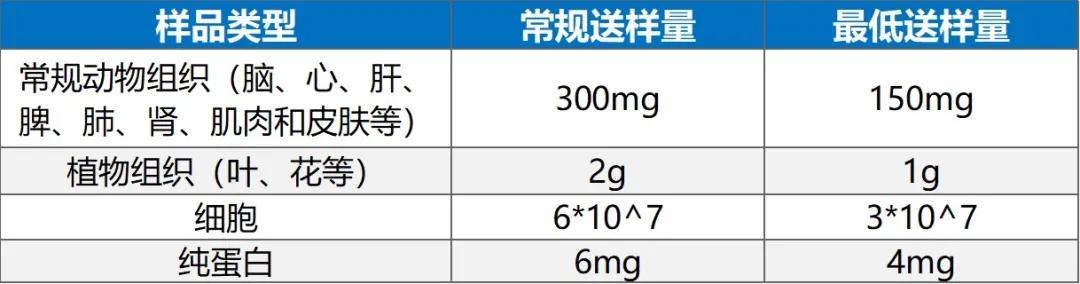 拜谱生物棕榈酰化、亚硝基化、氧化还原修饰组学送样建议
拜谱生物棕榈酰化、亚硝基化、氧化还原修饰组学送样建议
应用方向
拜谱生物棕榈酰化、亚硝基化、氧化还原修饰可广泛应用于医学肿瘤分子分型、疾病标志物筛选、疾病调控机制、药物靶点研究、生殖发育等;植物生长发育、抗逆机制、病理等;以及食品安全与检测等方面。
应用案例
1、棕榈酰化:糖尿病
文献名称:Palmitoylation couples insulin hypersecretion with β cell failure in diabetes
发表期刊:Cell Metabolism(IF=31.373)
发表时间:2023
技术方法:棕榈酰化修饰蛋白质组学
样品类型:人/小鼠胰岛细胞、组织
研究内容:该研究对人体胰岛组织、细胞进行了系统的研究,发现人体组织胰岛素的过量生产与棕榈酰化过程相关,并且这种棕榈酰化作用可被酰基蛋白硫酯酶1(APT1)逆转。通过棕榈酰化蛋白质组学发现,Scamp1是定位于胰岛素分泌颗粒的APT1底物,被敲低后会引起胰岛素分泌过多,促进β细胞衰竭,提示棕榈酰化参与糖尿病的发病过程。该研究模拟了某些形式的人类2型糖尿病的发病机制,为高风险人群提供了预防或延缓糖尿病的潜在靶点。
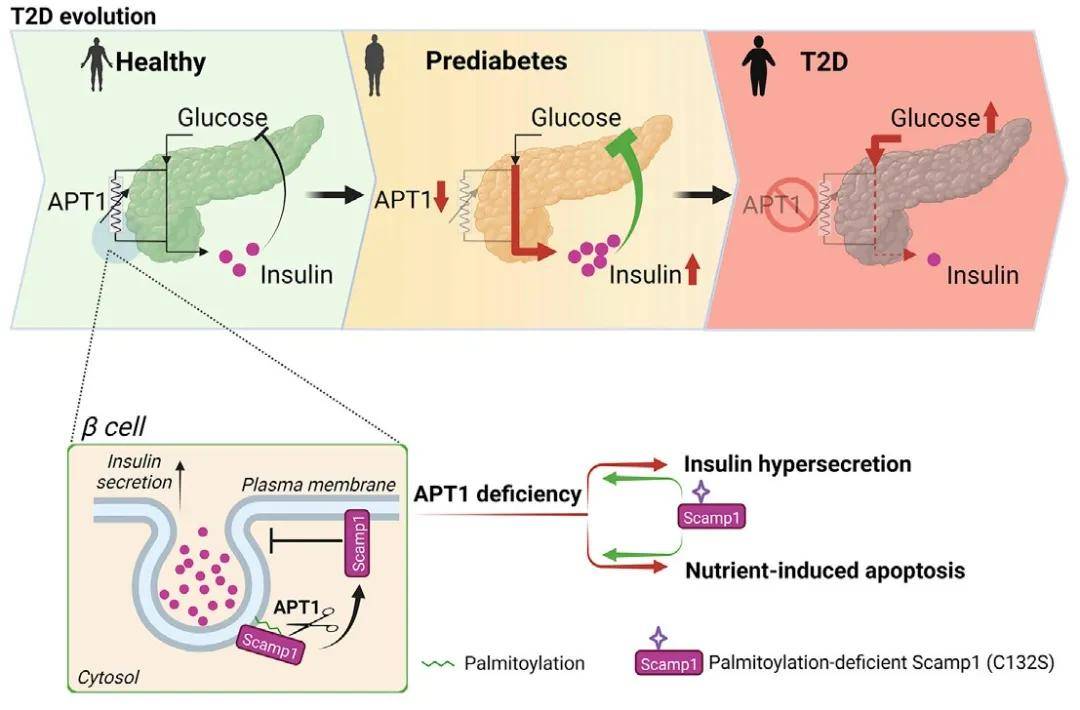 棕榈酰化参与糖尿病的发病过程
棕榈酰化参与糖尿病的发病过程
(图源:Dong G, et al., Cell Metab, 2023)
2、亚硝基化:十字花科作物育种
文献名称:Stigm are ceptors control intraspecies and interspecies barriers in Brassicaceae
发表期刊:Nature(IF= 69.5)
发表时间:2023
技术方法:亚硝基化修饰蛋白质组学(拜谱生物提供技术服务)
样品类型:大白菜
研究内容:该研究证明了SI花粉决定因素S-locus半胱氨酸富集蛋白/S位点蛋白11(SCR/SP11)或UI花粉信号与SI雌性决定因子S-locus受体激酶(SRK)结合,激活FER结构域进而介导ROS含量从而抑制SI柱头与UI花粉相结合;且触发NO,亚硝酸FER也会抑制SC柱头中的ROS,以种内优先的方式促进花粉生长,保持物种完整性。该研究研发了打破远缘杂交生殖隔离的育种技术,成功获得了大白菜的种间、属间远缘杂交胚,开辟了远缘杂交育种的新思路和新途径。
 打破十字花科作物远程育种的柱头屏障
打破十字花科作物远程育种的柱头屏障
(图源:Huang J, et al., Nature, 2023)
3、氧化还原修饰:衰老
文献名称:A Quantitative Tissue-Specific Landscape of Protein Redox Regulation during Aging
发表期刊:Cell(IF=38.637)
发表时间:2020
技术方法:氧化还原修饰蛋白质组学
样品类型:小鼠心脏、肝脏、脑等组织
研究内容:在该研究中,研究人员开发了Oximouse,对小鼠体内半胱氨酸氧化还原蛋白质组进行了全面的定量和定位,揭示了半胱氨酸氧化还原网络具有组织选择性。此外,研究人员还全面鉴定了氧化还原修饰的疾病网络,为氧化还原失调和组织衰老之间长期存在的联系建立了系统的分子基础,同样也表明了蛋白质组学在生物医学领域研究中的重要战略意义。
 氧化还原调节蛋白与疾病网络的年龄依赖性重塑
氧化还原调节蛋白与疾病网络的年龄依赖性重塑
(图源:Xiao H, et al., Cell, 2020)
技术学习
半胱氨酸PTM类型主要有三类,包括脂质PTM(S-棕榈酰化等)、氧化PTM(S-亚硝基化、S-谷胱甘肽化、S-二硫化等),和代谢物PTM。这些修饰导致一系列生化反应并调节各种生理和病理过程,例如自噬、蛋白质稳定、氧化还原稳态和细胞信号传导等。
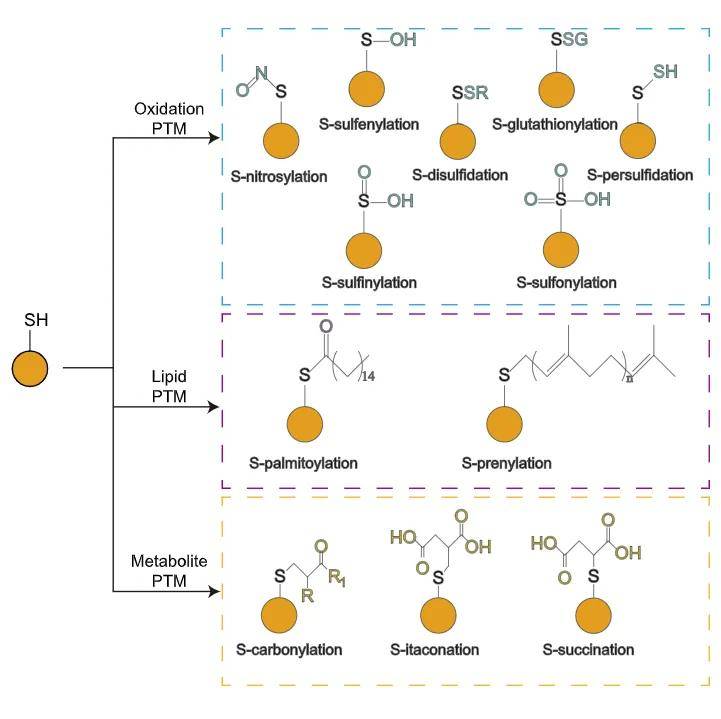 半胱氨酸修饰类型
半胱氨酸修饰类型
(图源:CysModDB网站,https://cysmoddb.bioinfogo.org/)
1、棕榈酰化
棕榈酰化修饰(palmitoylation或S-palmitoylation或S-acylation)根据其连接方式可以分为S-棕榈酰化、N-棕榈酰化和O-棕榈酰化。其中,S-棕榈酰化是指含有16个碳原子的饱和棕榈酸和蛋白的半胱氨酸残基的S端结合,形成不稳定的硫酯键,这种棕榈酰化具有可逆性,可在时间和空间上调节蛋白质的功能,因此棕榈酰化修饰通常是指S-棕榈酰化。在所有脂质化修饰中,棕榈酰化修饰作用最普遍,影响约20%的蛋白质组。
棕榈酰化增加了蛋白质的疏水性,增强了蛋白与细胞膜的亲和性,将胞浆蛋白瞬时靶向到细胞膜上,因而可用于研究蛋白质的转运和定位。此外,棕榈酰化将蛋白质束缚到膜微域中,例如脂筏,从而调节蛋白质的活性、稳定性和多蛋白质复合物的形成。
 蛋白质S-棕榈酰化修饰
蛋白质S-棕榈酰化修饰
(图源:Sobocińska J, et al., Front Immunol, 2018)
2、亚硝基化
一氧化氮(NO)作为第二信使通过两种信号传导途径对细胞产生影响,一种是cGMP信号通路,另一种与之平行的信号传导途径就是S-亚硝基化。NO基团与蛋白的半胱氨酸巯基(S端)共价连接形成稳定的亚硝基硫醇,这种蛋白修饰被称为亚硝基化修饰(nitrosylation或S-nitrosylation)。亚硝基化基于氧化还原的信号传导,通过调节酶活性、亚细胞定位或蛋白质-蛋白质相互作用从而影响蛋白质的功能。
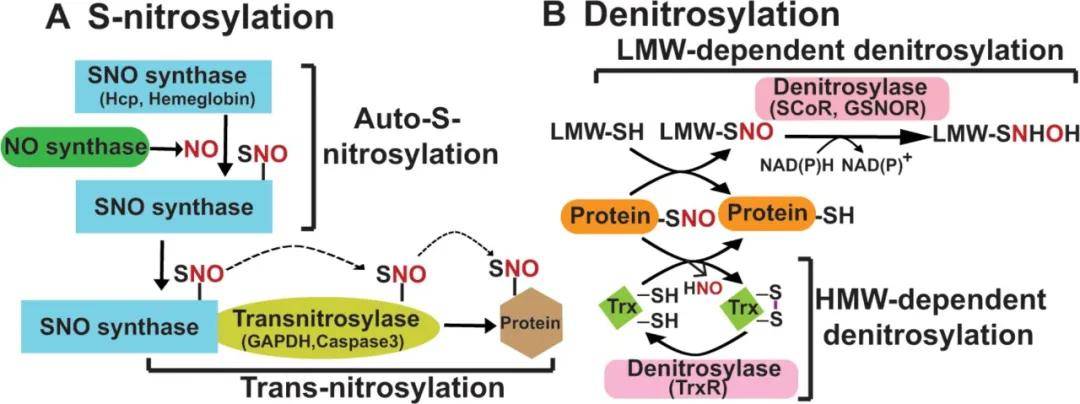 蛋白质S-亚硝基化修饰
蛋白质S-亚硝基化修饰
(图源:Zhou HL, et al., Nat Rev Endocrinol, 2022)
3、氧化还原
蛋白质半胱氨酸氧化修饰由活性氧(ROS)介导,包括二硫键(S-S)形成、S-谷胱甘肽化(SSG)、S-亚硝基化(SNO)、S-亚磺酰化(SOH)等,这几种半胱氨酸氧化修饰可以被相应的还原剂还原成游离巯基(-SH),这种可逆的修饰可以调节蛋白质的构象和功能,包括基因转录,代谢,信号转导,凋亡,以及蛋白质的运输和亚细胞定位,进而影响细胞生理过程和细胞稳态。
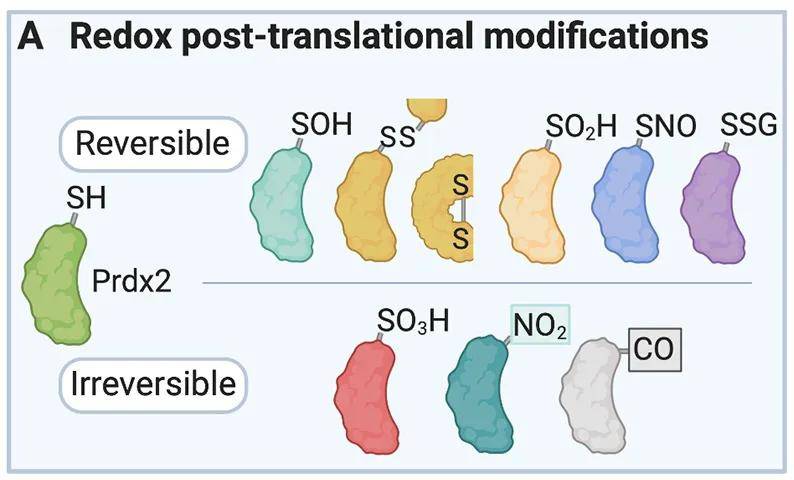 半胱氨酸氧化修饰类型
半胱氨酸氧化修饰类型
(图源:Finelli MJ, Front Aging Neurosci, 2020)
4、谷胱甘肽化
在氧化应激状态下,蛋白质上的半胱氨酸残基和谷胱甘肽(Glutathione,GSH)可以形成混合型二硫键,发生蛋白质的谷胱甘肽化,其去谷胱甘肽化过程主要由谷氧还蛋白(Grx1)催化。蛋白质S-谷胱甘肽化是一种可逆的翻译后修饰,可以改变蛋白质结构、活性、亚细胞定位以及与小分子和其他蛋白质的相互作用,一方面可以保护蛋白免于发生磺酸化等不可逆的氧化损伤,另一方面和磷酸化修饰一样发挥信号转导功能,在各种生理活动和病理事件中的氧化还原信号传导和调节中起着关键作用。
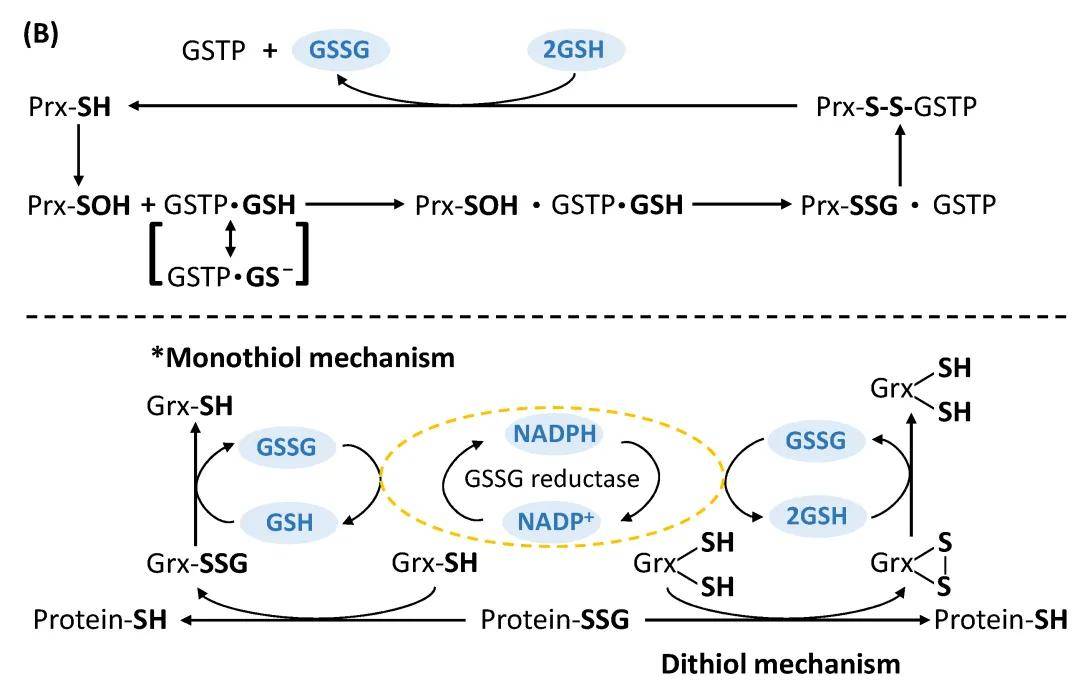 蛋白质S-谷胱甘肽化修饰
蛋白质S-谷胱甘肽化修饰
(图源:Li X, Zhang T, et al., Antioxidants (Basel), 2022)
参考文献:
[1] Meng Y, Zhang L, Zhang L, et al. CysModDB: a comprehensive platform with the integration of manually curated resources and analysis tools for cysteine posttranslational modifications.Brief Bioinform. 2022;23(6):bbac460. doi:10.1093/bib/bbac460.
[2] Dong G, Adak S, Spyropoulos G, et al. Palmitoylation couples insulin hypersecretion with β cell failure in diabetes [published online ahead of print, 2023 Jan 6]. Cell Metab. 2023;S1550-4131(22)00549-doi:10.1016/j.cmet.2022.12.012.
[3] Huang J, Yang L, Yang L, et al. Stigma receptors control intraspecies and interspecies barriers in Brassicaceae [published online ahead of print, 2023 Jan 25]. Nature. 2023;10.1038/s41586-022-05640-x. doi:10.1038/s41586-022-05640-x.
[4] Xiao H, Jedrychowski MP, Schweppe DK, et al. A Quantitative Tissue-Specific Landscape of Protein Redox Regulation during Aging. Cell. 2020;180(5):968-983.e24. doi:10.1016/j.cell.2020.02.012.
[5] Li X, Zhang T, Day NJ, Feng S, Gaffrey MJ, Qian WJ. Defining the S-Glutathionylation Proteome by Biochemical and Mass Spectrometric Approaches. Antioxidants (Basel). 2022;11(11):2272. Published 2022 Nov 17. doi:10.3390/antiox11112272.