

众所周知,蛋白质是生命的物质基础,也是基因功能的执行者。而许多蛋白质前体是没有活性的,需要经过翻译后修饰(PTM)等复杂过程才具有生理功能,因此PTM已成为生物学研究中的重要内容。蛋白棕榈酰化修饰是作用最普遍的脂酰化修饰,影响约20%的蛋白组。然而由于一般的棕榈酰蛋白含量低,高特异性富集棕榈酰修饰困难等技术挑战,极大地阻碍了该领域的进一步研究。拜谱生物采用ABE结合质谱高通量方法,以无偏倚地发现整个蛋白质组中的棕榈酰化,为各位科研工作者的研究带来“独特视角”,助力提升课题及文章水平。那么棕榈酰化参与调控哪些疾病过程的蛋白功能变化?该修饰有哪些重要的科研意义?以及该产品的特色优势,今天将为大家一一揭秘。
01 、可逆的S-棕榈酰化修饰
通常所指的棕榈酰化(S-palmitoylation或S-acylation)为S-棕榈酰化,是指棕榈酸和蛋白质半胱氨酸的巯基结合,形成不稳定的硫酯键,这种棕榈酰化具有可逆性,由棕榈酰基转移酶(PAT)和去棕榈酰化酶(APT)介导调控,其中DHHC是一个保守的重要的PAT家族。
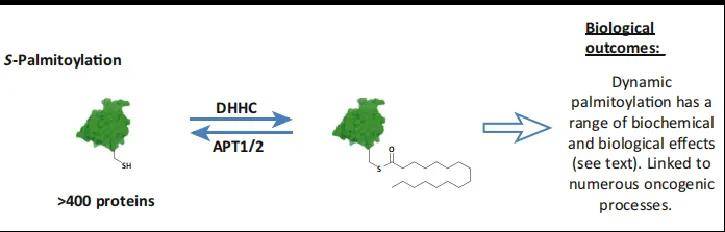 图1 由DHHC和APT介导的可逆S-棕榈酰化
图1 由DHHC和APT介导的可逆S-棕榈酰化
(图片再编辑,源自:Thomas Lanyon-Hogg, et al., Trends Biochem Sci, 2017)
02 、棕榈酰化广泛参与生理过程
最近的综述全面列出了棕榈酰化蛋白,包括从支架和信号蛋白到离子通道和受体,这些棕榈酰化蛋白广泛参与免疫反应、癌症、代谢、转录、神经生物学和信号等生理过程,尤其是在突触传递、先天免疫反应、GPCR和酪氨酸激酶信号和转录因子功能等领域的生理影响。棕榈酰化修饰可以调节靶标蛋白的定位和功能,在维持细胞稳态中具有至关重要的作用。例如,免疫代谢糖蛋白CD36,一种清道夫受体和脂肪酸易位酶,中断CD36棕榈酰化将改变脂肪酸摄取、JNK/NF-κΒ信号,甚至AMPK激活的脂肪酸β-氧化,其与非酒精性脂肪肝炎有关。
 图2 棕榈酰化蛋白及其广泛的生理影响
图2 棕榈酰化蛋白及其广泛的生理影响
(图源:Saara-Anne Azizi, et al., Acc Chem Res, 2019)
03 、棕榈酰化与多种疾病关联
蛋白质棕榈酰化在疾病中的作用可以先从酶的方向来探讨,棕榈酰基转移酶DHHCs在许多生物过程中的作用已经确立,其介导的棕榈酰化失调会导致一系列后果,这些病理后果以组织特异性的方式发生,如ZDHHC3、7、9、13和15参与神经疾病的发病机制;ZDHHC7和20与癌症有关;ZDHHC1、5、11、13、21参与代谢性疾病;ZDHHC2、3、6、7、8、15、19和20参与感染性疾病。
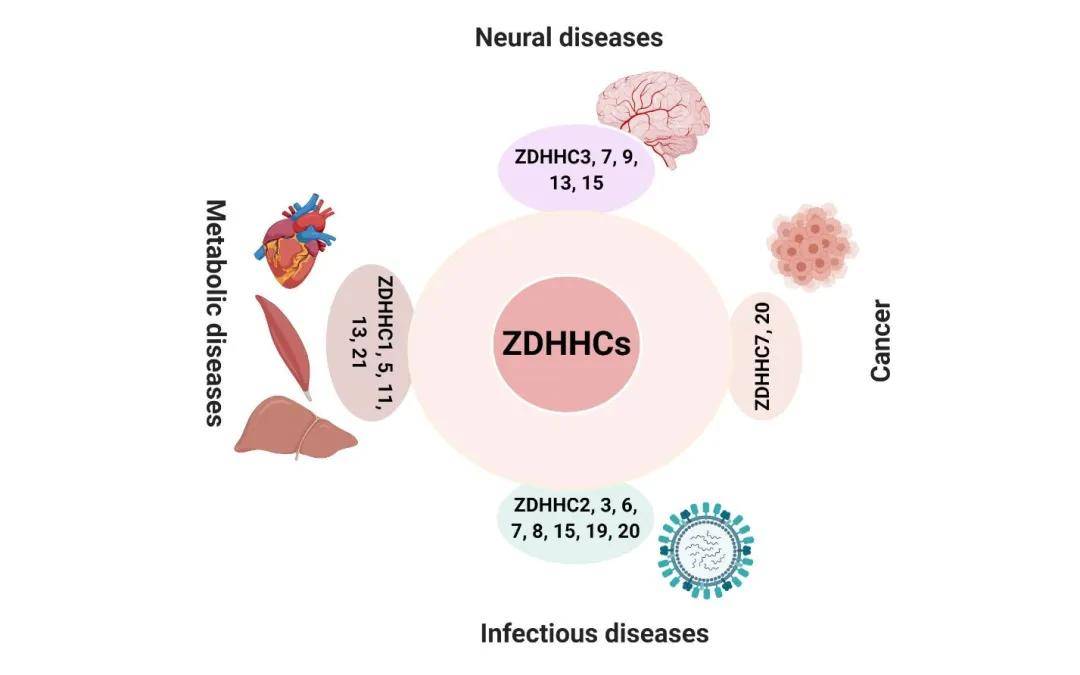 图3 棕榈酰基转移酶ZDHHCs组织特异性的调控人类多种疾病
图3 棕榈酰基转移酶ZDHHCs组织特异性的调控人类多种疾病
(图源:Lu Hu, et al., RSC Chem Biol, 2021)
1) 癌症
一些重要的癌症相关蛋白是被棕榈酰化修饰的。一个经典的例子是RAS家族的小GTPases,HRAS、NRAS和KRAS-4A都会发生可逆地S-棕榈酰化,这对于定位质膜并能够转化细胞至关重要,决定了运输和信号特性。另一方面,从更广泛的角度来看,Bailey等人将最近299个已验证的癌症驱动因子与SwissPalm(一个蛋白棕榈酰化数据库)匹配,结果有78个(26%)的编码蛋白质是棕榈酰化的,表明了这种修饰与癌症的相关性。
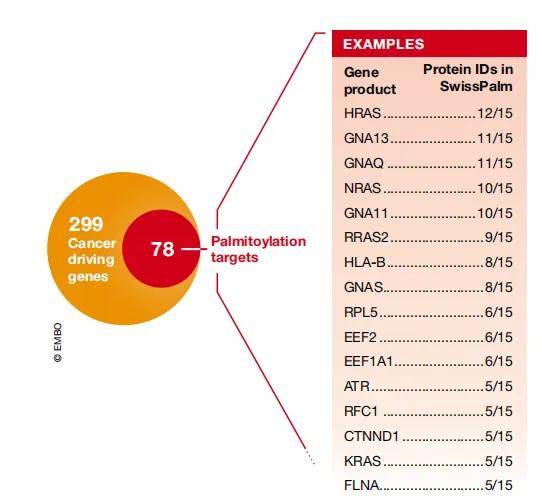 图4 许多癌症驱动因子都是棕榈酰化的
图4 许多癌症驱动因子都是棕榈酰化的
(图源:Pin-Joe Ko & Scott J Dixon, EMBO Rep, 2018)
上海交大许杰团队此前报道发现PD-L1棕榈酰化的存在,并对其进行了深入的功能和机制探究,这种修饰通过阻断PD-L1的泛素化来稳定PD-L1,从而抑制溶酶体对PD-L1的降解。并设计了一种竞争性的PD-L1棕榈酰化抑制剂,可降低肿瘤细胞中PD-L1的表达,以增强T细胞对肿瘤的免疫。这一研究为克服PD-L1介导的癌症免疫逃逸提供了新的策略。2022年4月,瑞士日内瓦大学的科学家Gonzalo P Solis等人也在《Nat Commun》中表示,蛋白质棕榈酰化有望成为抗癌药物的新靶点,相关结果在“Local and substrate-specific S-palmitoylation determines subcellular localization of Gαo”一文中。
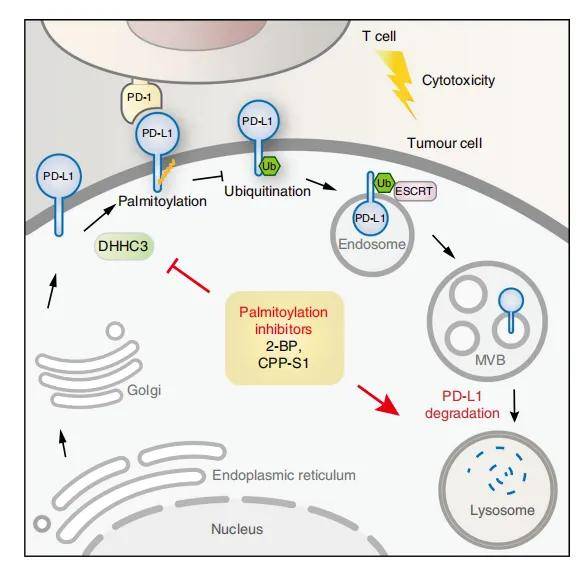 图5 探究PD-L1棕榈酰化的调控机制将有助于癌症治疗
图5 探究PD-L1棕榈酰化的调控机制将有助于癌症治疗
(图源:Han Yao, et al., Nat Biomed Eng, 2019)
2) 传染性疾病,以新冠为例
新冠病毒粒子被一层脂质双分子层包围,其中含有SARS-CoV-2 S等膜蛋白,SARS-CoV-2 S负责靶细胞结合和病毒融合。在病毒感染期间,SARS-CoV-2 S发生大量棕榈酰化修饰,尤其是SARS-CoV-2 S在内质网和高尔基体内10个胞质半胱氨酸上发生快速棕榈酰化。进一步研究表明,SARS-CoV-2 S棕榈酰化在病毒包膜内产生富含胆固醇的脂质结构域,棕榈酰化和脂质生物合成途径促进新冠病毒的传染性。该研究指向棕榈酰化修饰酶和脂质生物合成酶是新型抗病毒治疗靶点。
此外,SARS-CoV-2 S的棕榈酰化对于合胞体形成和SARS-CoV-2假病毒颗粒进入至关重要。ZDHHC2、ZDHHC3、ZDHHC4、ZDHHC5、ZDHHC8、ZDHHC9、ZDHHC11、ZDFHC14、ZDHHC16、ZDHHC19和ZDHHC20的过度表达促进了S的棕榈酰化,这些ZDHHCs被鉴定为与SARS-CoV-2 S相关。
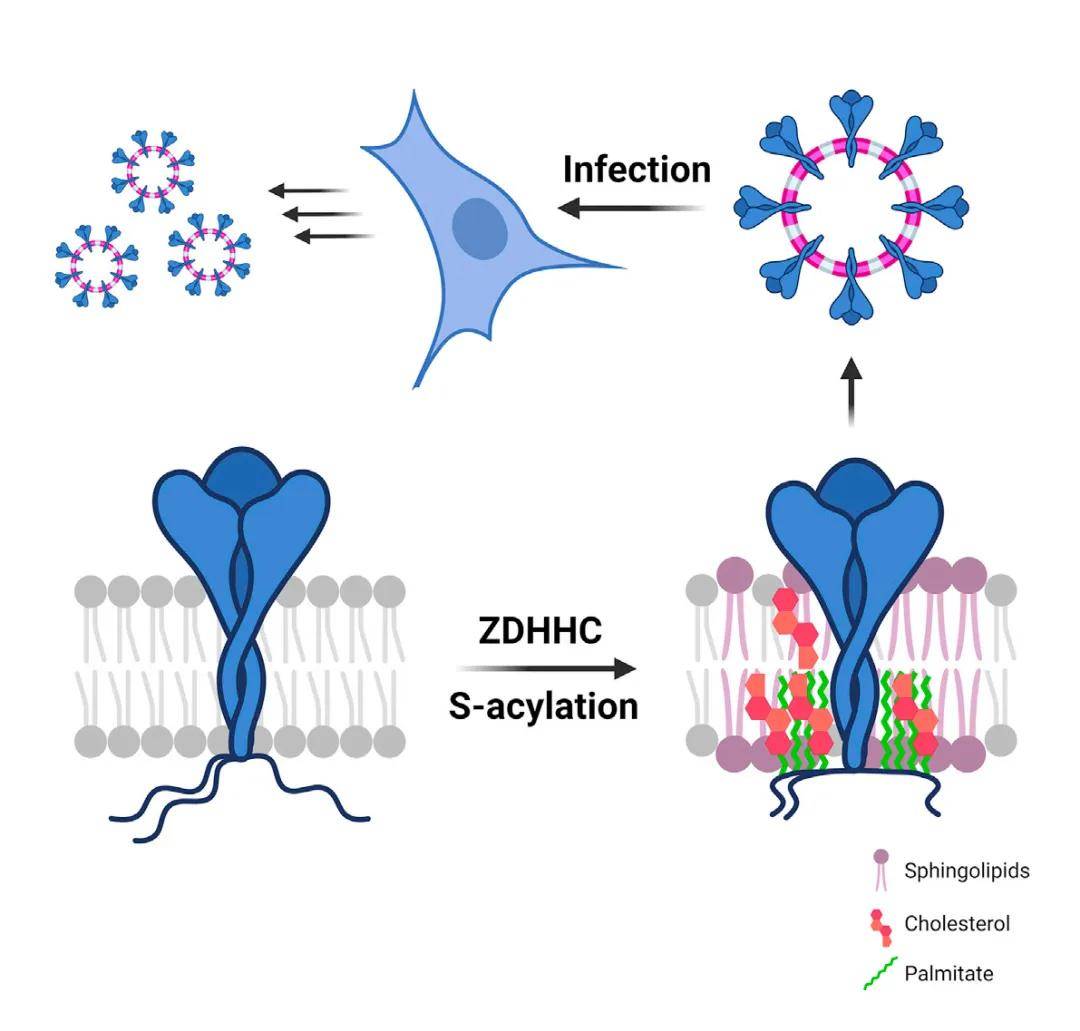 图6 S-棕榈酰化控制SARS-CoV-2膜脂组织,增强传染性
图6 S-棕榈酰化控制SARS-CoV-2膜脂组织,增强传染性
(图源:Francisco S Mesquita, et al., Dev Cell, 2021)
2021年,苏州大学生物医学研究院周芳芳教授课题组在Advanced Materials上发表了题为“Engineering Extracellular Vesicles Enriched with Palmitoylated ACE2 as COVID-19 Therapy”的研究论文,该研究发现血管紧张素转化酶2(ACE2,一种直接与SARS-CoV-2 S相互作用的关键受体)存在棕榈酰化修饰,且棕榈酰化对ACE2的膜靶向和胞外囊泡分泌至关重要。该研究设计了富含棕榈酰化ACE2的胞外囊泡,利用该囊泡饱和SARS-CoV-2 S作为病毒陷阱,抑制SARS-CoV-2的感染。
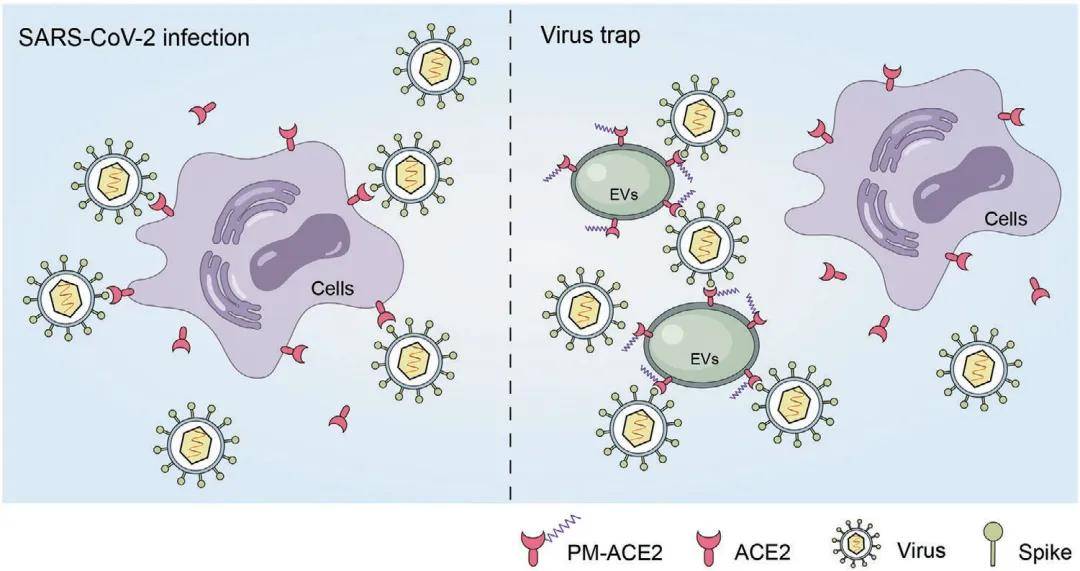 图7 设计富含棕榈酰化ACE2的胞外囊泡用以治疗新冠肺炎
图7 设计富含棕榈酰化ACE2的胞外囊泡用以治疗新冠肺炎
(图源:Feng Xie, et al., Adv Mater, 2021)
3) 代谢性疾病,以糖尿病为例
2023年1月11日,美国华盛顿大学Clay F. Semenkovich团队在Cell Metabolism上发表了题为“Palmitoylation couples insulin hypersecretion with β cell failure in diabetes”的文章。该研究发现人体组织胰岛素的过量生产与棕榈酰化过程相关,这种棕榈酰化作用可被酰基蛋白硫酯酶1(APT1)逆转。通过棕榈酰化蛋白质组学发现,Scamp1是APT1的底物,定位于胰岛素分泌颗粒,敲低Scamp1会引起胰岛素分泌过多,促进β细胞衰竭,提示棕榈酰化参与糖尿病的发病过程。该研究不仅有助于理解糖尿病发病机制,同时为高风险人群提供了预防或延缓糖尿病的潜在靶点。
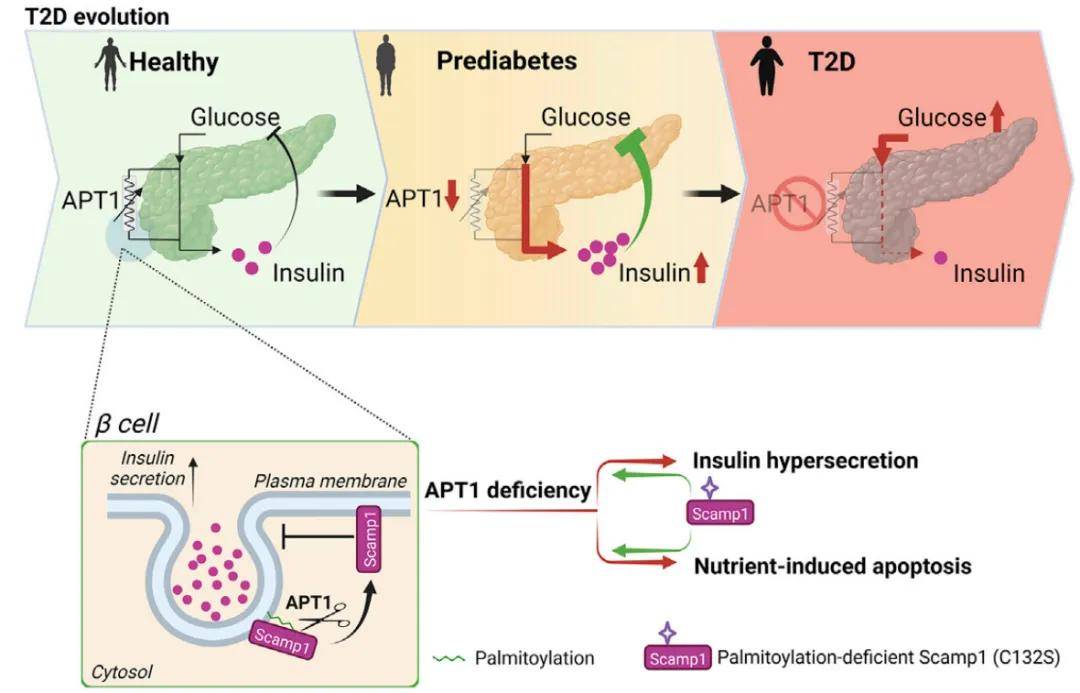 图8 棕榈酰化使糖尿病患者胰岛素分泌亢进与β细胞衰竭
图8 棕榈酰化使糖尿病患者胰岛素分泌亢进与β细胞衰竭
(图源:Guifang Dong, et al., Cell Metab, 2023)
4) 神经类疾病
棕榈酰化在神经元信号平台组装中的作用已被深入研究,D2多巴胺受体(D2R)调节情绪和认知,与精神分裂症和帕金森病有关,Cys443是质膜保留所需的棕榈酰化位点,研究发现D2R与DHHC3、DHHC4和DHHC8相互作用。ZDHHC9已被确定为神经功能的关键调节因子,海马培养物中缺乏ZDHHC9导致树突结构变短和抑制性突触减少。ZDHHC9可以通过介导Ras棕榈酰化激活ERK通路。棕榈酰化Ras定位于质膜,激活下游MAPK信号通路,导致树突生长,ZDHHC9在神经网络中平衡兴奋性和抑制性信号。ZDHHC9功能丧失突变导致棕榈酰化水平失调,将涉及神经相关疾病,如X连锁智力障碍(XLID)和癫痫。ZDHHC13已被证明在维持焦虑相关行为、运动功能和大脑生物能学方面发挥关键作用。ZDHHC13的功能缺失突变导致包括Drp1在内的许多底物的低棕榈酰化水平。此外,ZDHHC13功能障碍也与代谢和退行性疾病有关。
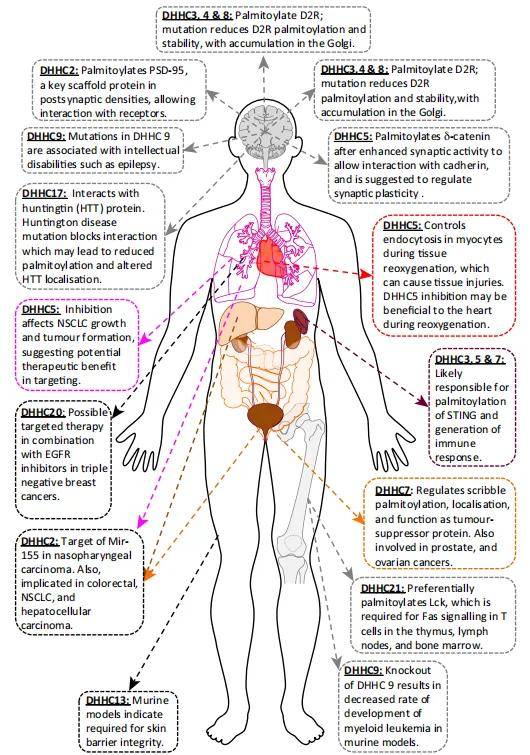 图9 DHHC介导底物棕榈酰化修饰,调控生理病理功能
图9 DHHC介导底物棕榈酰化修饰,调控生理病理功能
如在心脏复氧(DHHC5)中的作用;神经功能,如突触可塑性(DHHC5);产生免疫应答(DHHC21);智力障碍(DHHC9);结直肠癌、肝细胞癌和非小细胞肺癌(NSCLC;DHHC2);和白血病(DHHC9)
(图源:Thomas Lanyon-Hogg, et al., Trends Biochem Sci, 2017)
04 、拜谱独家修饰——棕榈酰化修饰蛋白组
棕榈酰化修饰蛋白组是对生物样品中的棕榈酰化位点/肽段进行全局无偏的定性定量分析,用于探究上述疾病相关的生物学机制和靶标发现。拜谱生物作为国内首家提供该服务的公司,可以助力科研工作者开展多个领域的研究,以下是我公司该产品的特点:
1) ABE方法
棕榈酰化尽管在1979年提出并于1980年在细胞培养中得到验证,但检测蛋白质棕榈酰化的技术挑战极大地阻碍了该领域的进一步研究,直到21世纪,随着酰基-生物素交换法(ABE)的出现,对该领域功能和调控的理解才获得快速发展。ABE利用硫酯键的不稳定性将棕榈酰化转化为生物素基团,可以以半胱氨酸特异性的方式观察底物棕榈酰化。
2) 项目经验丰富,棕榈酰化位点鉴定量突破2万
拜谱生物棕榈酰化PTM平台拥有丰富的服务经验:在动物组织和细胞项目中具有稳定优势,目前为多家高校和医院单位提供了细胞、卵巢、肿瘤、皮肤、乳腺、肝脏等样品的数据检测与分析服务,位点鉴定量最高可达2w+水平;在植物果实和花朵的研究中也呈现出优秀的数据,如蕃茄花的位点鉴定量高达1w+。在病原真菌、病虫害的研究中也不断积累经验,目前承接过的样品类型有稻瘟菌菌丝、稻曲菌等。
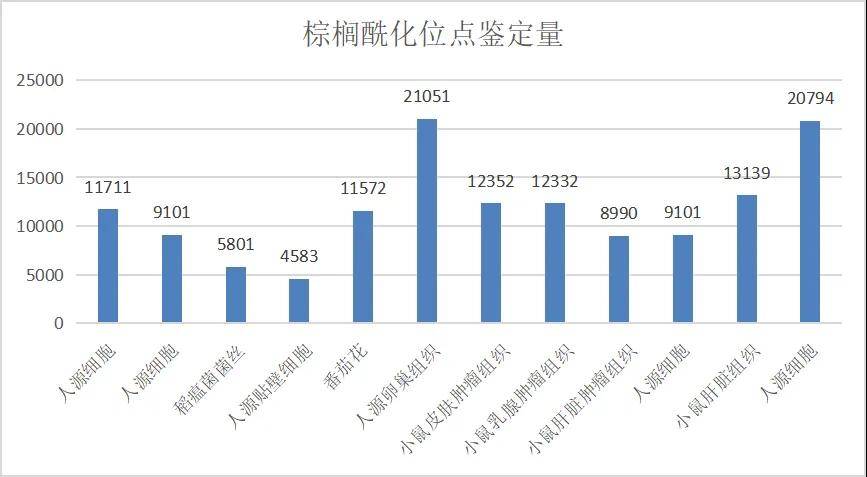 图10 拜谱生物棕榈酰化修饰蛋白组的部分项目经验
图10 拜谱生物棕榈酰化修饰蛋白组的部分项目经验
3) 靶标发现与验证“一站式”分析
在疾病标志物检测、药物开发、生物信号通路研究中,我们推荐组合方案:棕榈酰化修饰蛋白组+棕榈酰化PRM验证,一站式解决靶标发现与验证。
4) 类型丰富的半胱氨酸修饰组
蛋白质中的半胱氨酸是一个极其活跃的残基,可以进行多种翻译后修饰,因此除棕榈酰化修饰蛋白组检测以外,我们还可提供亚硝基化、谷胱甘肽化以及Total 氧化还原修饰蛋白组分析,以及次磺酸化和巯基化正在开发测试中。
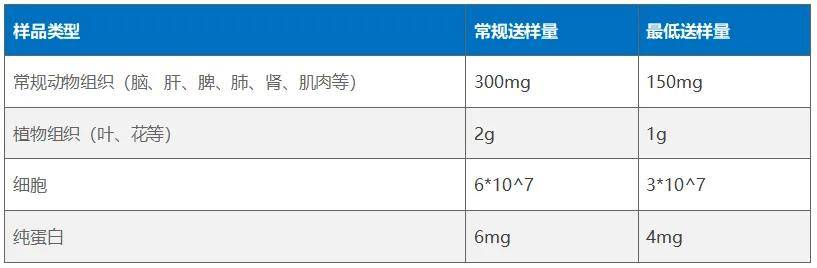
5) 送样建议
参考文献:
[1] Lanyon-Hogg T, Faronato M, Serwa RA, Tate EW. Dynamic Protein Acylation: New Substrates, Mechanisms, and Drug Targets. Trends Biochem Sci. 2017;42(7):566-581. doi:10.1016/j.tibs.2017.04.004
[2] Azizi SA, Kathayat RS, Dickinson BC. Activity-Based Sensing of S-Depalmitoylases: Chemical Technologies and Biological Discovery. Acc Chem Res. 2019;52(11):3029-3038. doi:10.1021/acs.accounts.9b00354
[3] Hu L, Tao Z, Wu X. Insights into auto-S-fatty acylation: targets, druggability, and inhibitors. RSC Chem Biol. 2021;2(6):1567-1579. Published 2021 Aug 25. doi:10.1039/d1cb00115a
[4] Ko PJ, Dixon SJ. Protein palmitoylation and cancer. EMBO Rep. 2018;19(10):e46666. doi:10.15252/embr.201846666
[5] Yao H, Lan J, Li C, et al. Inhibiting PD-L1 palmitoylation enhances T-cell immune responses against tumours [published correction appears in Nat Biomed Eng. 2019 May;3(5):414]. Nat Biomed Eng. 2019;3(4):306-317. doi:10.1038/s41551-019-0375-6
[6] Mesquita FS, Abrami L, Sergeeva O, et al. S-acylation controls SARS-CoV-2 membrane lipid organization and enhances infectivity. Dev Cell. 2021;56(20):2790-2807.e8. doi:10.1016/j.devcel.2021.09.016
[7] Xie F, Su P, Pan T, et al. Engineering Extracellular Vesicles Enriched with Palmitoylated ACE2 as COVID-19 Therapy. Adv Mater. 2021;33(49):e2103471. doi:10.1002/adma.202103471
[8] Dong G, Adak S, Spyropoulos G, et al. Palmitoylation couples insulin hypersecretion with β cell failure in diabetes. Cell Metab. 2023;S1550-4131(22)00549-6. doi:10.1016/j.cmet.2022.12.012