

超重或肥胖的人患糖尿病的风险显著增加,2型糖尿病(T2D)的高血糖是由β细胞功能障碍引起的,通常是在胰岛素抵抗的情况下发生的,但是目前尚不清楚胰岛素分泌的增加是否会导致β细胞衰竭或促进糖尿病进程。营养过剩导致组织脂质堆积在T2D中很常见,而脂肪酸棕榈酸酯水平的升高与高胰岛素血症和β细胞功能障碍有关。
2023年1月6日,武汉轻工大学董桂芳教授与美国华盛顿大学Clay F. Semenkovich教授合作,在Cell Metabolism上发表了题为“Palmitoylation couples insulin hypersecretion with β cell failure in diabetes”的文章。该研究发现人体组织胰岛素的过量生产与棕榈酰化过程相关,并且这种棕榈酰化作用可被酰基蛋白硫酯酶1(APT1)逆转。通过棕榈酰化修饰蛋白组发现,Scamp1是定位于胰岛素分泌颗粒的APT1底物,被敲低后会引起胰岛素分泌过多,促进β细胞衰竭,提示棕榈酰化参与糖尿病的发病过程。该研究不仅有助于理解糖尿病发病机制,同时为高风险人群提供了预防或延缓糖尿病的潜在靶点。

英文标题:Palmitoylation couples insulin hypersecretion with β cell failure in diabetes
中文标题:棕榈酰化连接糖尿病患者的胰岛素过度分泌和β细胞衰竭
期刊:Cell Metabolism
影响因子:IF=31.373
发表时间:2023年1月6日
研究材料:人/小鼠胰岛细胞、组织
组学技术:棕榈酰化修饰蛋白组
主要研究结果
1.APT1表达、活性变化及对胰岛素分泌的影响
通过糖尿病患者和非糖尿病患者的比较,研究发现糖尿病患者中的APT1 mRNA升高(图1 A)。APT1酶活性的结果显示,高糖降低了三个不同的非糖尿病患者供体胰岛的去棕榈酰化活性,糖尿病患者β细胞APT1酶活性降低(图1 B-C)。通过对APT1 KD小鼠的研究,发现APT1的下降会引起葡萄糖刺激的胰岛素分泌升高(图1 G-H)。
 图1 人胰岛APT1表达、酶活性及APT1缺陷对胰岛素分泌的影响
图1 人胰岛APT1表达、酶活性及APT1缺陷对胰岛素分泌的影响
(图片再编辑,源自:Dong G, et al., Cell Metab, 2023)
进一步通过对APT1 KO小鼠的研究,发现16.7 mM葡萄糖刺激时,胰岛素分泌增加(图2 A);动态葡萄糖刺激实验显示,敲除组胰岛素双相释放增加(2 B、C)。
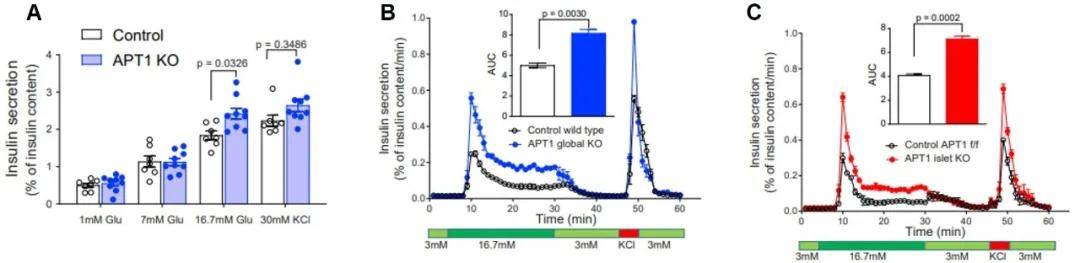 图2 APT1缺陷小鼠分离的胰岛可增加葡萄糖刺激的胰岛素分泌
图2 APT1缺陷小鼠分离的胰岛可增加葡萄糖刺激的胰岛素分泌
(图片再编辑,源自:Dong G, et al., Cell Metab, 2023)
2.Scamp1是APT1的底物,棕榈酰化缺陷突变体Scamp1的表达可挽救APT1缺陷引起的胰岛素高分泌和营养诱导的细胞凋亡
棕榈酰化通过许多参与胰岛素分泌的蛋白介导神经元突触囊泡融合,APT1会影响神经元疾病模型中的功能和细胞内运输,为深入探究APT1及其底物相互作用关系,研究人员进行了棕榈酰化修饰蛋白组研究。结果显示,从对照组和APT1 KO组胰岛中检测到390个棕榈酰化蛋白(图3 A)。RAC测定显示,与对照细胞相比,APT1 KD细胞中Scamp1棕榈酰化增加(图3 B-C)。当Scamp1被敲除时,葡萄糖依赖性胰岛素分泌增加(图3 D-E)。进一步分析表明,Scamp1的半胱氨酸残基上会发生突变,与野生型Scamp1相比,C132S突变体的棕榈酰化修饰减少(图3 G-H)。
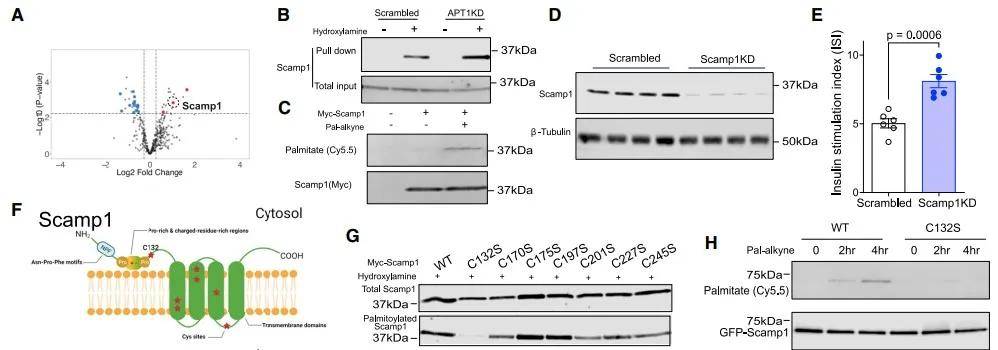 图3 Scamp1是APT1的底物
图3 Scamp1是APT1的底物
(图源:Dong G, et al., Cell Metab, 2023)
深入研究发现,C132S Scamp1可以阻止APT1缺乏引起的胰岛素高分泌(图4 B)。葡萄糖和棕榈酸酯联合作用24h后,APT1 KD细胞的凋亡率显著增加,C132S Scamp1可挽救APT1 KD细胞的凋亡(图4 C-E),表明APT1活性改变Scamp1棕榈酰化修饰的状态与营养诱导的细胞凋亡有关。
 图4 C132S可挽救APT1缺陷细胞中胰岛素分泌过多和营养诱导的细胞凋亡
图4 C132S可挽救APT1缺陷细胞中胰岛素分泌过多和营养诱导的细胞凋亡
(图源:Dong G, et al., Cell Metab, 2023)
3.胰岛特异性APT1基因敲除小鼠和APT1全敲db/db小鼠表现出更多的β细胞衰竭
为了确定T2D中β细胞衰竭的表型,对胰岛特异性APT1基因敲除小鼠和APT1全敲db/db小鼠进行研究。高脂饮食12周后,比较胰岛特异性APT1基因敲除小鼠和对照组小鼠,结果显示敲除组出现糖耐量受损的现象,这与给糖后15分钟胰岛素分泌和C-肽降低有关;并且出现β细胞面积下降(图 5)。
 图5 胰岛特异性APT1缺乏可促进高脂饮食诱导的小鼠β细胞衰竭
图5 胰岛特异性APT1缺乏可促进高脂饮食诱导的小鼠β细胞衰竭
(图源:Dong G, et al., Cell Metab, 2023)
对APT1缺陷的db/db小鼠进行研究,结果表明,APT1 KO组的糖耐量受损,并且胰岛素和C-肽的分泌减少(图6 A-I);β细胞面积显著减少,并出现明显的葡萄糖不耐受(图6 J-M)。比较有无Lypla1(编码APT1的基因)的小鼠,发现db/db小鼠胰岛中的Scamp1棕榈酰化程度高于对照db/+小鼠(图6 N),表明db/db小鼠的β细胞衰竭可能与清除Scamp1中棕榈酸盐的功能受损有关。
 图6 APT1缺乏可促进db/db小鼠的β细胞功能衰竭
图6 APT1缺乏可促进db/db小鼠的β细胞功能衰竭
(图源:Dong G, et al., Cell Metab, 2023)
小结
综上所述,该研究表明,APT1在人类胰岛中受到调节,APT1缺乏会导致胰岛素高分泌进而导致β细胞衰竭,其底物是Scamp1,棕榈酰化缺陷突变体Scamp1的表达可挽救APT1缺乏引起的胰岛素高分泌和营养诱导的细胞凋亡,提示棕榈酰化参与了糖尿病的发病机制。该研究模拟了某些形式的人类2型糖尿病的发病机制,为高风险人群提供了预防或延缓糖尿病的潜在靶点。
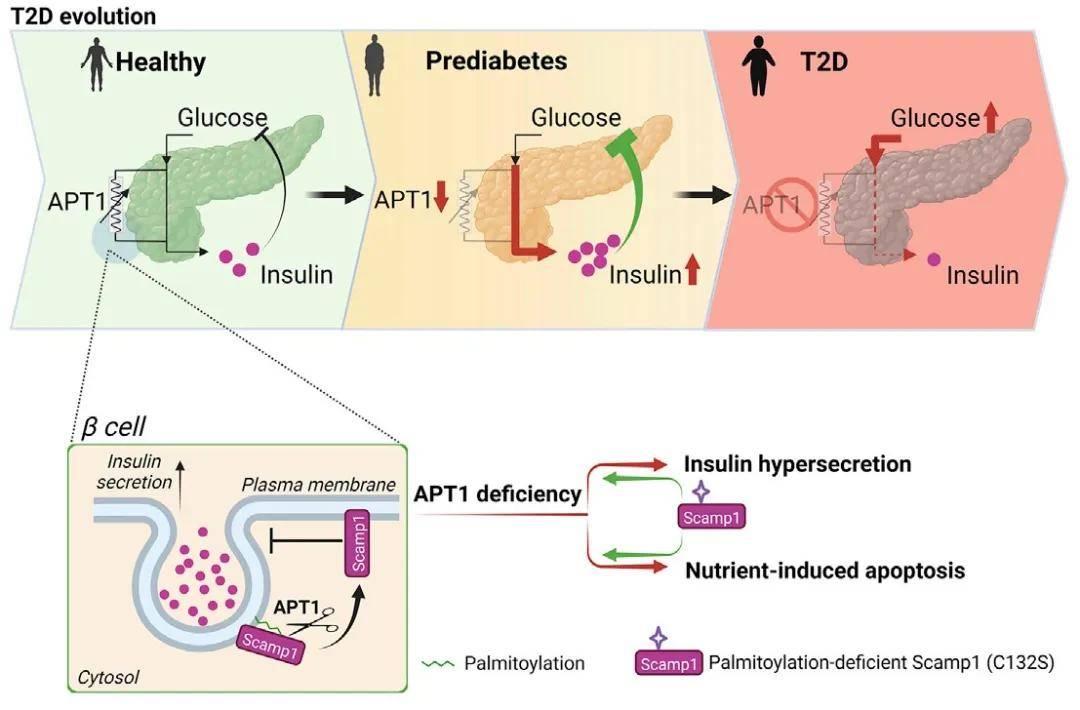 APT1影响胰岛素分泌
APT1影响胰岛素分泌
(图源:Dong G, et al., Cell Metab, 2023)
拜谱小结
棕榈酰化是重要的脂质化修饰形式,一般发生在半胱氨酸残基上。棕榈酰化修饰最重要的功能是增强可通行蛋白与膜的亲和性,从而调控蛋白质的定位与功能。拜谱生物独家组学技术,不仅可以对半胱氨酸残基上的棕榈酰化修饰进行测定,还可以测定半胱氨酸残基上的亚硝基化、氧化还原修饰,优化修饰肽段富集流程,修饰位点鉴定数目大幅度提升,低丰度修饰位点定量准确,助力病理机制、治疗靶点等研究。
参考文献:Dong G, Adak S, Spyropoulos G, et al. Palmitoylation couples insulin hypersecretion with β cell failure in diabetes [published online ahead of print, 2023 Jan 6]. Cell Metab. 2023; S1550-4131(22)00549-6. doi:10.1016/j.cmet.2022.12.012.