

背景介绍
提到“系统性硬化症(SSc)”,这种以皮肤内脏纤维化、血管病变为核心的罕见病,因其临床异质性强,长期让医患陷入“治疗难、预判难”的困境,表明潜在的分子异质性。尽管研究已经表征了三种常见SSc亚型 (ACA、ATA、ARA) 的分子特征,但罕见的自身抗体亚型(U1RNP、U3RNP、Ku、Th/To)仍未被探索。
近日,上海交通大学吕良敬教授团队与丁显廷教授团队共同在风湿病学国际顶级期刊《Annals of the Rheumatic Diseases》(IF:20.6)上发表题为“Shared and unique molecular signatures across different autoantibody groups in systemic sclerosis: a multiomics analysis.”的重要研究,首次通过血液多组学分析,全面揭示了SSc不同自身抗体亚型间共性与特异的分子图谱,为未来真正的个体化精准治疗指明了方向。

研究对象
SSc患者
共166例,按自身抗体亚型分为7组,ACA 55例、ATA 58例、ARA 24例、、U1RNP 12例、U3RNP 8例、Ku 4例、Th/To 5例
健康对照HC:48例
核心技术
整合血浆蛋白质组学、PBMC 转录组学、免疫细胞表型分析(流式细胞术)、血浆代谢组学四大技术,从蛋白、基因、细胞、代谢物四个维度层层拆解疾病机制。
技术路线
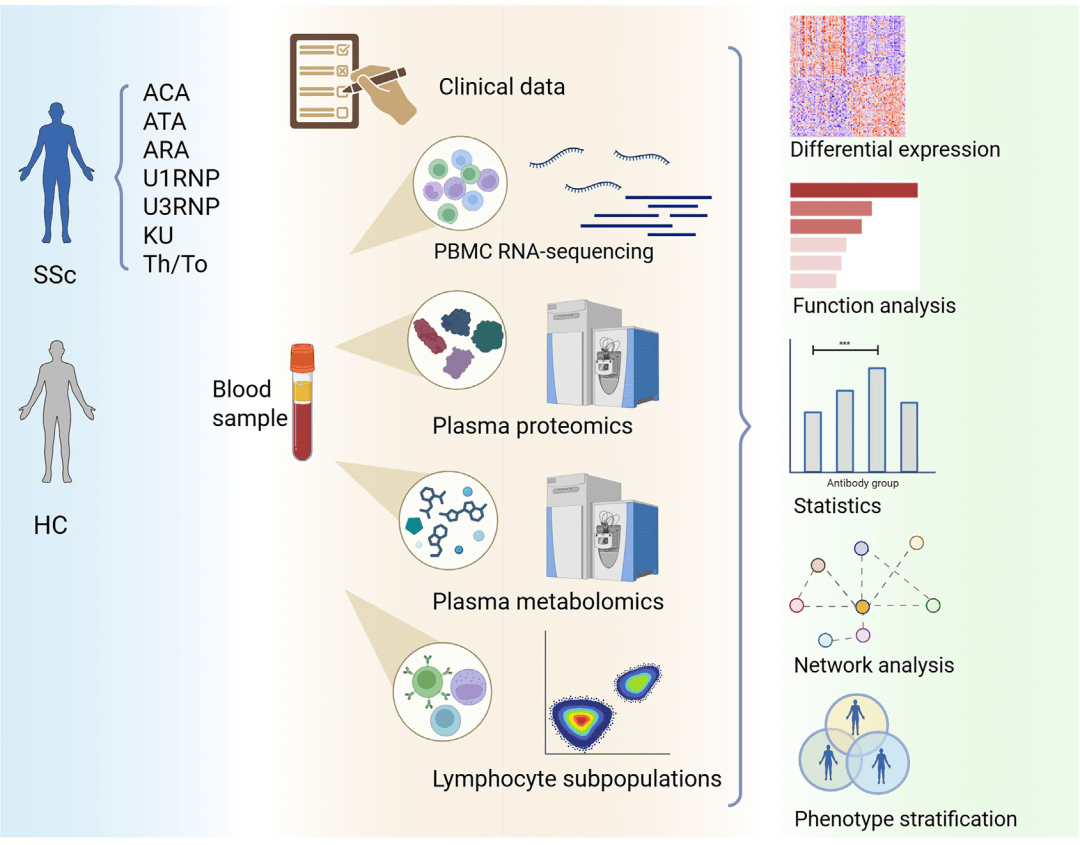
核心共性
所有SSc患者的共同病理基石
无论患者携带何种自身抗体,研究都发现了一套共通的分子特征。血浆蛋白质组分析显示,所有SSc亚组均出现内皮损伤标志物(如VWF、VCAM1)和细胞外基质成分(如SPON1、COL6A2)的普遍上调,提示血管病变和纤维化是疾病的共同起点(图1A-C)。与此同时,转录组学数据揭示,外周血免疫细胞中的I型干扰素信号通路(以STAT1基因为核心)被广泛激活,构成了共同的炎症基调(图2A-C)。这些发现勾勒出SSc的核心病理三角:血管损伤、异常纤维化和慢性免疫激活。
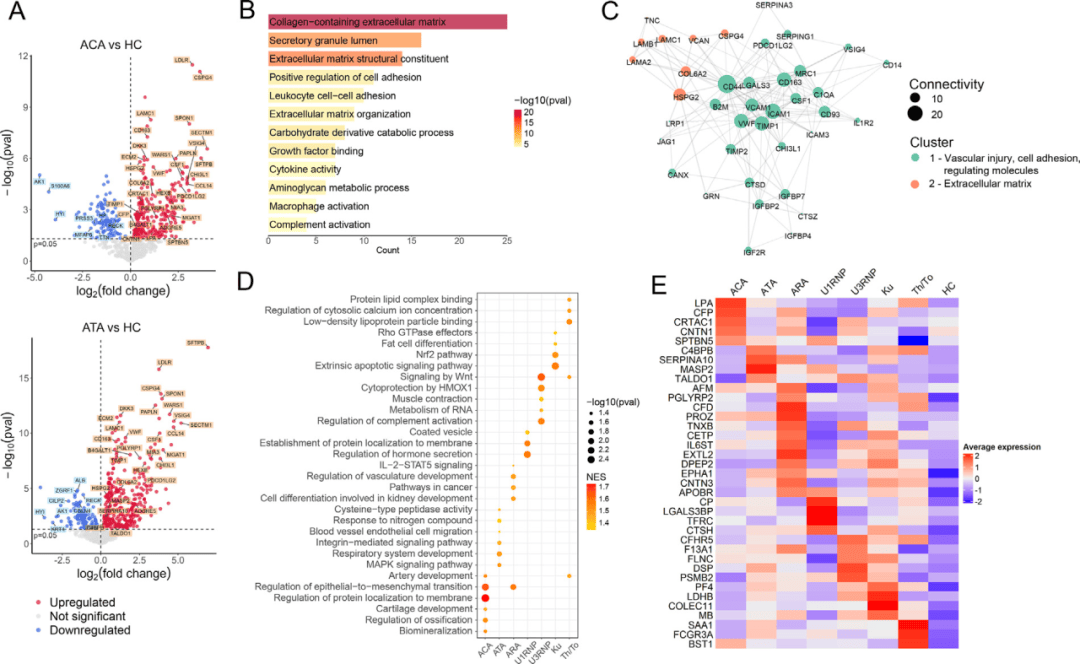
图1:血浆蛋白组结果
独特指纹
抗体特异性通路决定临床表型
在共有特征之上,每个抗体亚型都“绘制”了独特的分子图案。ACA阳性患者在蛋白质和基因层面均显示出与骨化和钙代谢相关的通路富集,这为其好发皮肤钙质沉着症提供了直接机制解释(图1D-E)。ATA阳性患者则呈现出强烈的氧化应激和NADPH代谢特征,可能是驱动其更严重纤维化表型的关键引擎(图1D-E, 图2D-E)。ARA阳性患者的独特之处在于癌症相关通路和肾脏标志物的上调,与其临床上的高肿瘤风险和肾危象倾向相符(图1D-E)。
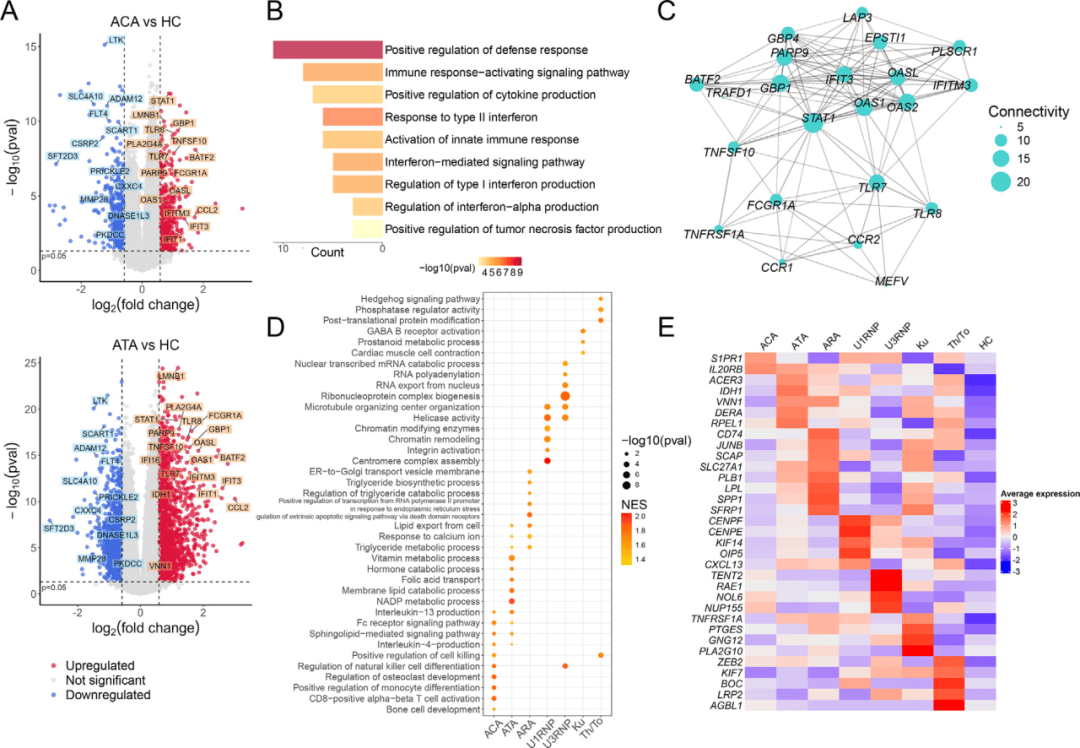
图2:PBMC转录组结果
免疫图谱
细胞层面的亚型异质性
免疫细胞表型分析进一步细化了各亚型的特征。研究发现,ATA和Th/To组患者的中性粒细胞计数显著升高,暗示了更强的急性炎症状态(图3A-B)。更关键的是,所有SSc患者的调节性B细胞(Bregs)均呈现减少趋势,其中在ACA、ATA和U1RNP组中下降尤为显著,这表明免疫抑制功能的普遍受损是SSc免疫失调的共同短板(图3D-E)。这些细胞水平的差异,为理解不同抗体亚型炎症程度的轻重提供了直接证据。
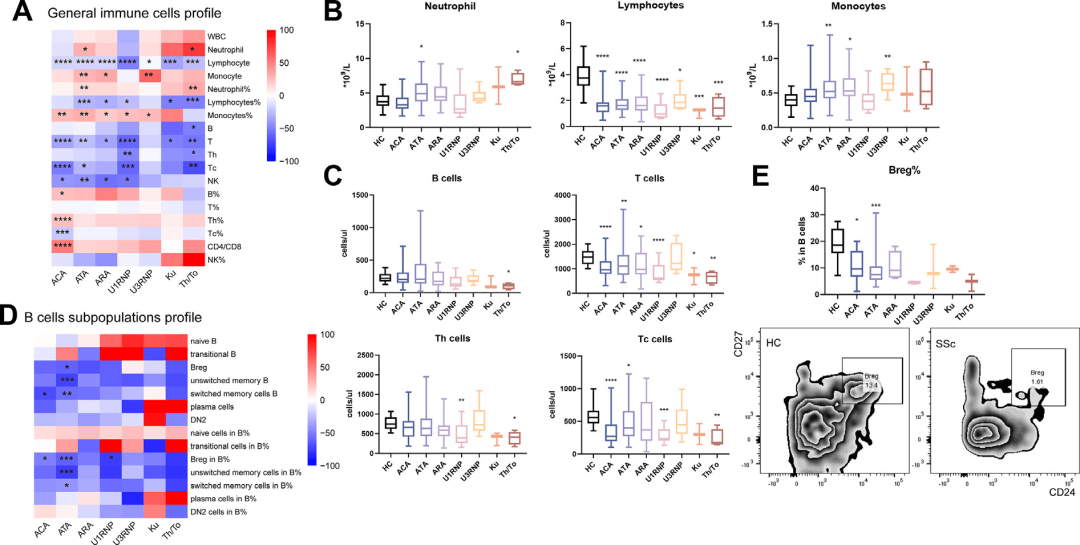
图3:免疫细胞表型分析
代谢重编程
从代谢物窥见器官受累线索
代谢组学提供了另一维度的见解。所有SSc患者均存在氨基酸代谢和牛磺酸代谢的共同紊乱(图4A-B)。而各亚组又展现出独特的代谢“签名”:例如,Th/To组患者体内与肺动脉高压发展密切相关的色氨酸代谢产物5-羟色氨酸显著积累;U3RNP/Ku组则出现肌肉能量代谢相关物质的变化,与它们常伴发肌炎的临床特征相呼应(图4C-D)。这些特异性代谢改变,可能是连接自身免疫与特定器官损伤的重要桥梁。
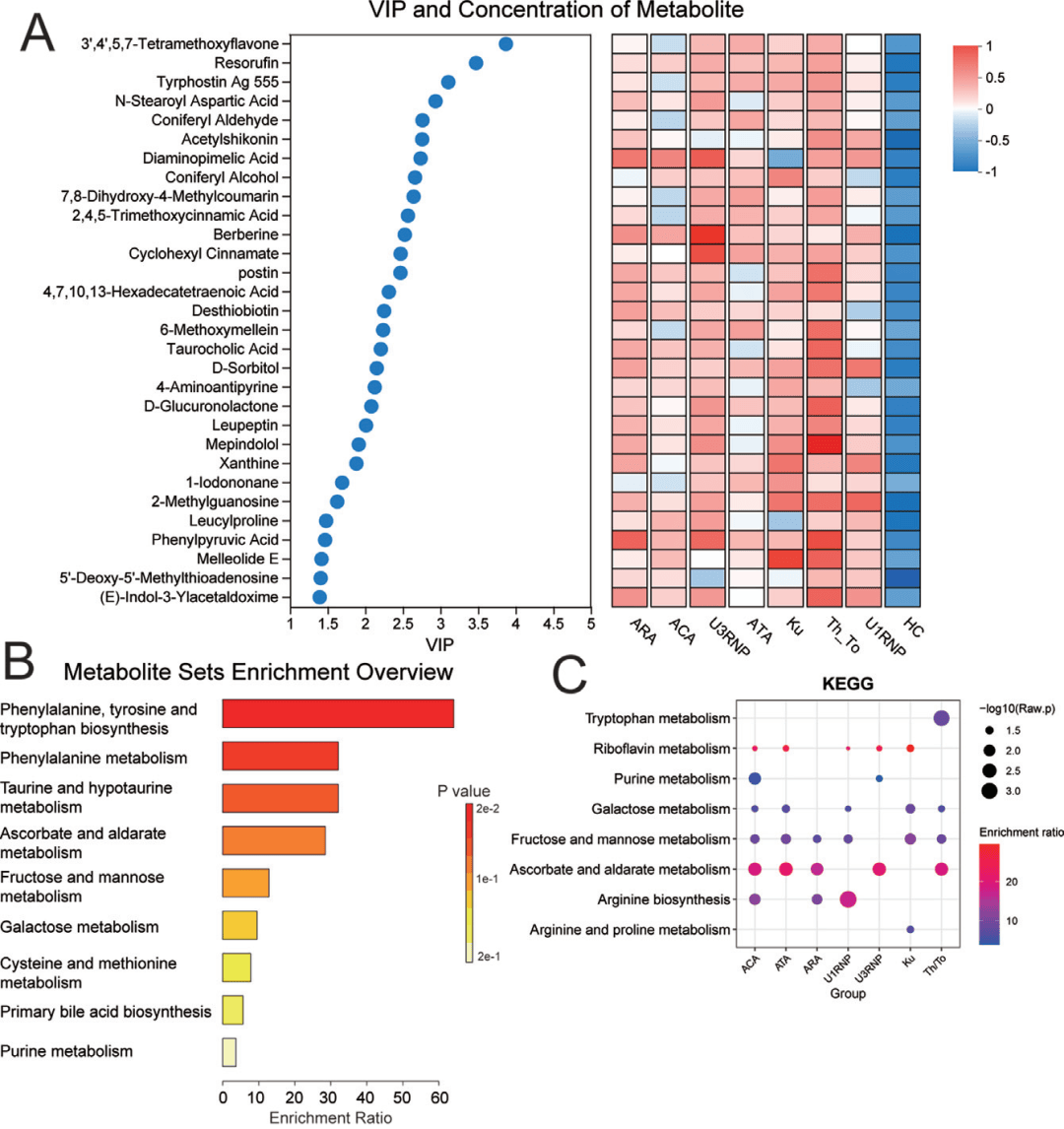
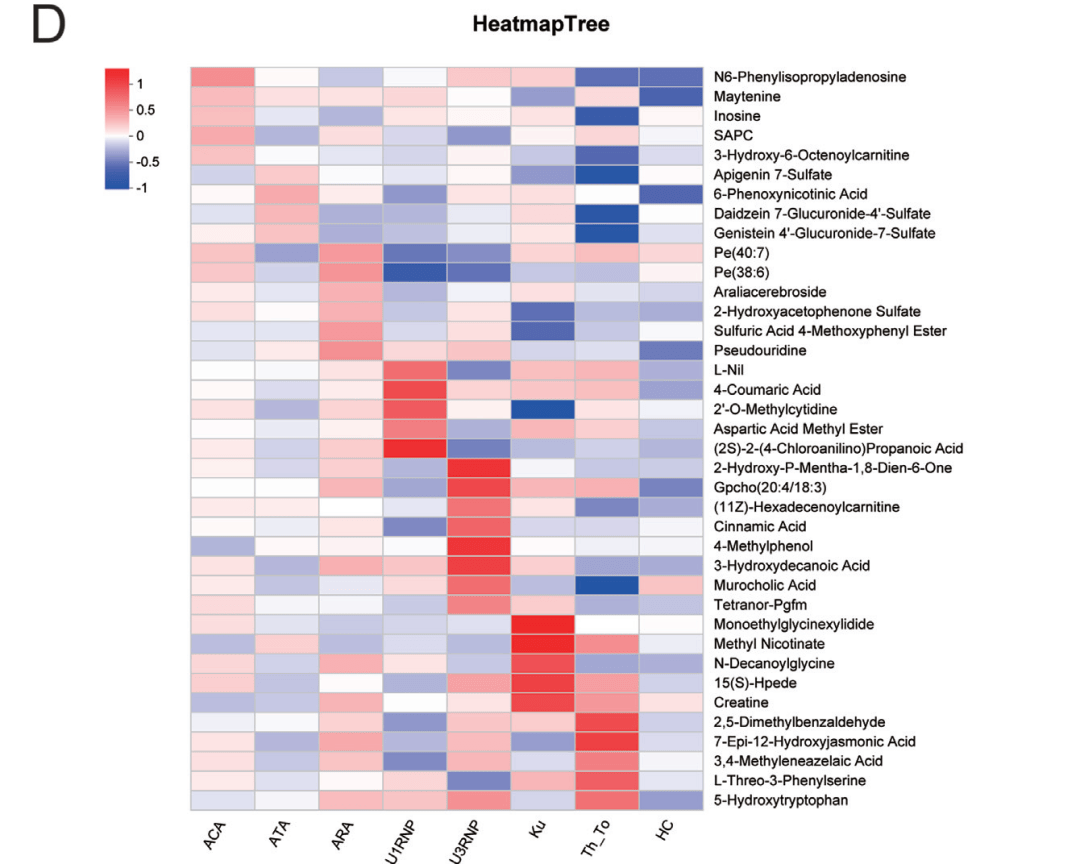
图4:血浆代谢组结果
文章小结
本研究通过自身抗体分层与多组学分析,揭示SSc各亚群共享内皮损伤、免疫失调及纤维化核心病理,但不同抗体赋予独特机制特征:ACA钙化、ATA氧化应激、ARA癌通路、U1RNP核酸感知、U3RNP/Ku肌肉受累、Th/To代谢异常。该发现支持基于抗体分型的精准治疗策略,为靶向干预提供了分子依据。
拜谱小结
血液蛋白质组成直接反映了机体的病理生理状态。本研究通过对166例患者进行系统性血浆蛋白质组分析,从1159个血浆蛋白中,筛选出86个共享标志物及多个亚型特异性分子,构建出SSc的精准分型框架。
血液蛋白质组的检测深度,决定了疾病分子分型的精度与临床转化潜力。拜谱生物超高深度血液蛋白质组检测平台,凭借其覆盖8000+种血浆蛋白的深度和出色的定量稳定性,正是实现此类大队列、精细化分型研究的理想工具。它能从复杂的血液样本中稳定捕获低丰度、高价值的生物标志物,真正实现从“血液检测”到“机制解析”的跨越。
参考文献
Lin W,Zhao Z,Guo R, et al. Shared and unique molecular signatures across different autoantibody groups in systemic sclerosis: a multiomics analysis. Ann Rheum Dis. 2025;:. doi:10.1016/j.ard.2025.11.020