

表皮生长因子受体(EGFR)突变仍然是非小细胞肺癌(NSCLC)免疫治疗的主要挑战,由EGFR突变介导的肿瘤微环境(TME)调节相关的机制驱动,对免疫抑制剂反应不佳。
近日,山东大学齐鲁医院王秀问/刘延国团队 在 Advanced Science 杂志上发表了题为“Overcoming EGFR-Mediated Dendritic Cell Dysfunction to Enhance Anti-tumor Immunity in EGFR-Mutant NSCLC by Precisely Targeting CD73 With pH-responsive Nanocarriers”的研究文章。该文章开发了一种纳米颗粒,为克服非小细胞肺癌免疫治疗耐药性提供了一种极具潜力的治疗策略。拜谱生物为该研究提供了 医学广靶MT1000代谢组学 技术服务。

英文标题:Overcoming EGFR-Mediated Dendritic Cell Dysfunction to Enhance Anti-tumor Immunity in EGFR-Mutant NSCLC by Precisely Targeting CD73 With pH-responsive Nanocarriers(Advanced Science)
中文标题:克服EGFR介导的树突状细胞功能障碍,通过用pH响应性纳米载体精确靶向CD73,增强EGFR突变NSCLC的抗肿瘤免疫力
客户单位:山东大学齐鲁医院
研究材料:人源细胞上清
拜谱提供技术:医学广靶MT1000代谢组学
技术路线:
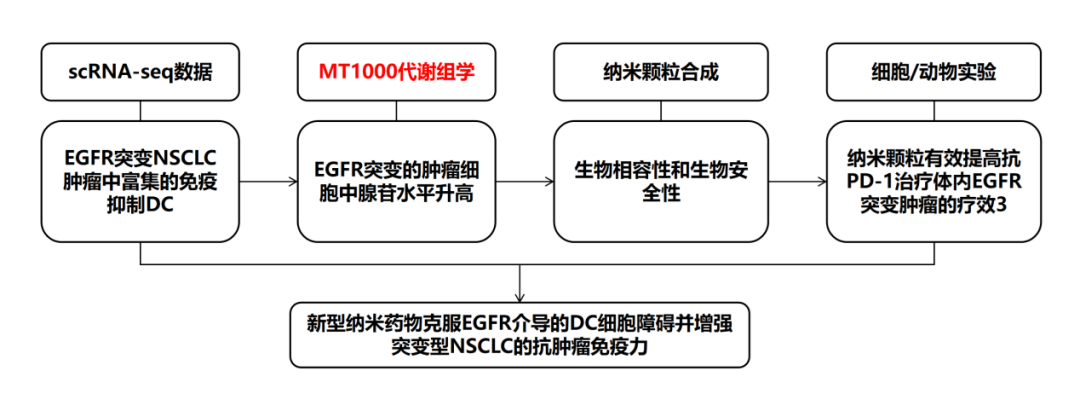
研究结果
01、EGFR突变NSCLC肿瘤中富集的免疫抑制DC
为了剖析晚期EGFR突变NSCLC的肿瘤微环境(TME)中是否存在独特的免疫细胞组成,研究人员将来自GSE131907数据集的scRNA-seq数据进行了分析。发现在EGFR突变组中,DC、成纤维细胞和肥大细胞的比例增加,但T细胞和NK细胞减少。对功能性DC亚组的进一步分析显示,EGFR突变患者的关键成熟标志物的表达显着降低。多重免疫荧光染色显示,与WT相比,EGFR突变患者的肿瘤浸润CD11cHLA-DR,CD11cCD86细胞和CD8淋巴细胞显着减少(图1)。为了表征EGFR突变与DC功能之间的关联,研究人员构建EGFR突变的人肺癌细胞系和体内模型,发现EGFR突变肿瘤抑制DC的招募和成熟,从而削弱适应性免疫反应的激活。
 图1 EGFR突变NSCLC的免疫景观和DC成熟
图1 EGFR突变NSCLC的免疫景观和DC成熟
02、EGFR突变的肿瘤细胞中腺苷水平升高
为了研究EGFR突变导致DC功能障碍的机制,研究人员对细胞的上清进行了医学广靶MT1000代谢组学分析。主成分分析(PCA)显示,两组之间存在明显的分离(图2a),鉴定了七类不同的代谢物(图2b)。进一步筛选两组间差异代谢物,鉴定出19个上调代谢物和3个下调代谢物(图2c-d)。其中腺苷是一种已知的免疫抑制代谢物,在EGFR-19del组中被发现明显上调(图2c-e)。试剂盒检测发现EGFR突变细胞产生的ATP和腺苷水平显着高于EGFR-WT细胞(图2f-g)。KEGG通路富集分析显示,核苷酸代谢通路受到严重破坏(图2h),这表明腺苷在TME中具有潜在的免疫抑制作用。因此发现腺苷含量的升高可能导致DC功能障碍和EGFR突变TME中特征的CD8⁺T细胞激活脱轨。
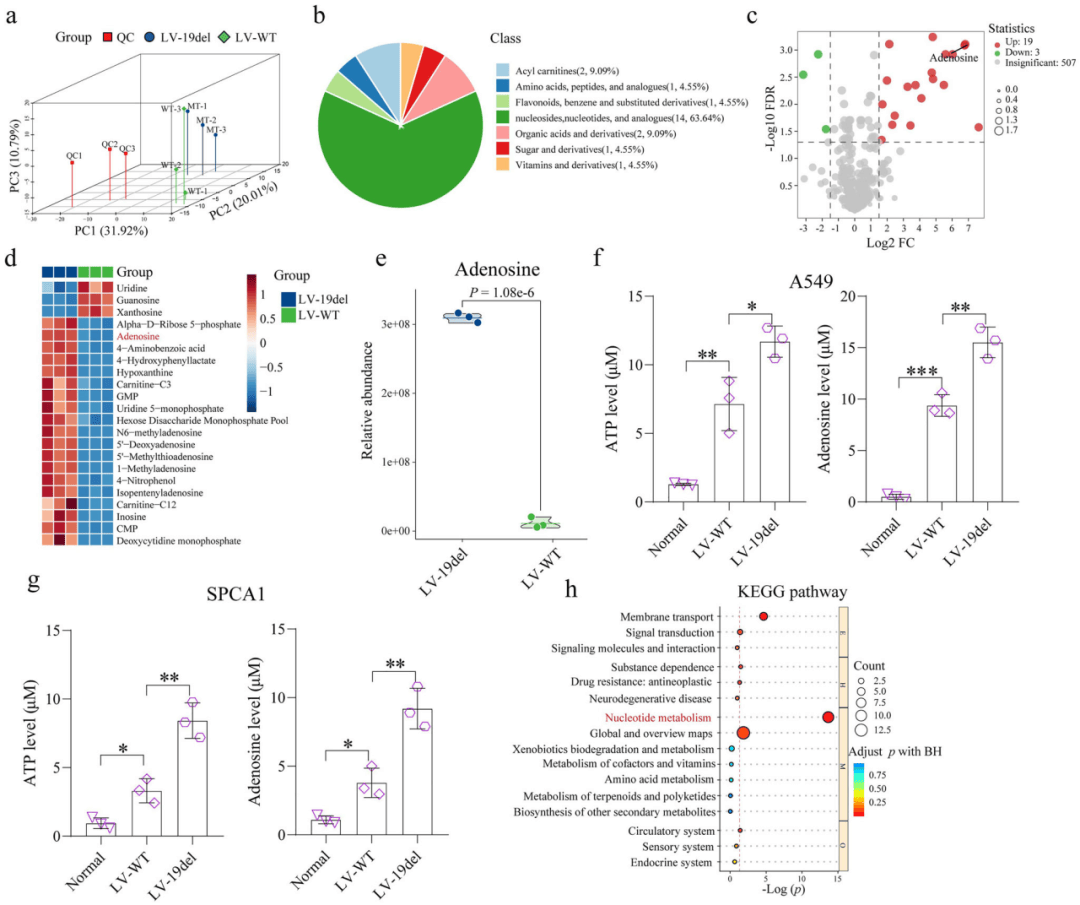 图2 细胞的代谢组学分析和关键代谢途径改变
图2 细胞的代谢组学分析和关键代谢途径改变
03、激活的ERK信号介导的EGFR驱动的CD73在肿瘤细胞中的表达
通过对TCGA数据集分析发现CD73在EGFR突变型NSCLC中过表达,与预后不良相关。为了阐明EGFR激活与CD73表达之间的关联,研究人员通过细胞实验和体内实验发现CD73在EGFR突变NSCLC中显着上调,这种异常表达不仅预示预后不良,而且有助于TME的免疫抑制重塑。为了表征EGFR驱动的CD73表达的分子机制,通过RT-qPCR和免疫印迹分析表明EGFR驱动的CD73表达是通过ERK信号通路介导的。
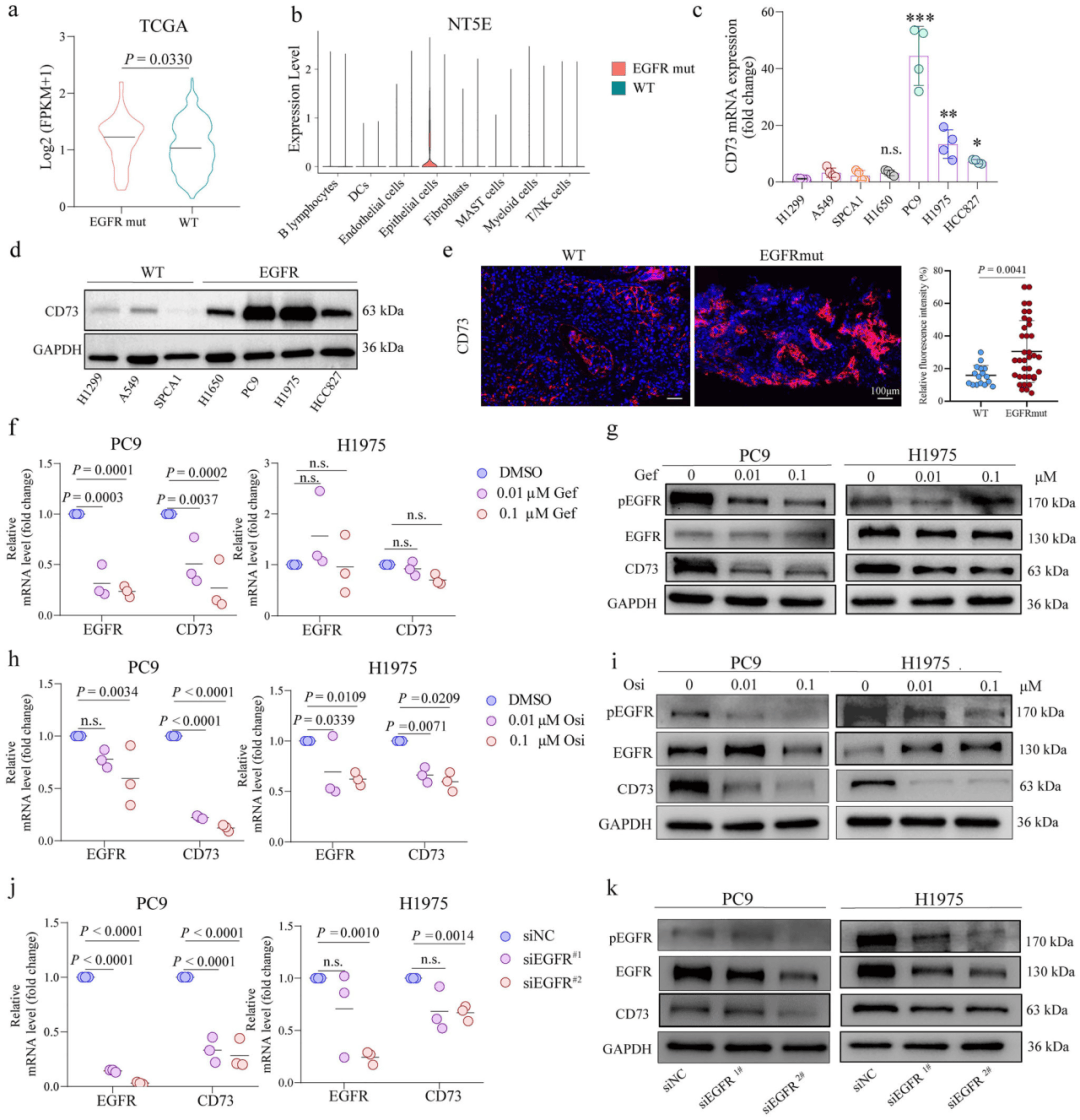 图3 CD73表达受EGFR在NSCLC中调控
图3 CD73表达受EGFR在NSCLC中调控
04、pH响应型纳米载体的合成与表征
研究人员设计了一种pH响应纳米载体可以将选择性CD73抑制剂(AB680)精确递送至酸性肿瘤区域。透射电镜和扫描电子显微镜下AB680纳米颗粒尺寸略大于对照。两种材料的zeta电位没有显著变化,表明AB680的内部载荷不会影响AB680的表面性能。随后对生物降解和释放以及安全性进行测试,AB680纳米颗粒发现具有良好的生物相容性和生物安全性。
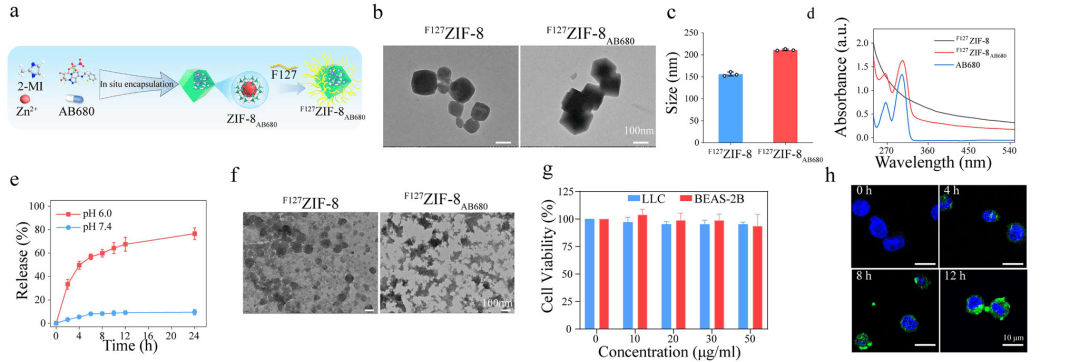 图4 pH响应型纳米载体的合成与表征
图4 pH响应型纳米载体的合成与表征
05、纳米颗粒有效提高抗PD-1治疗体内EGFR突变肿瘤的疗效
研究人员进行小鼠实验,设置5个组别,结果发现纳米颗粒优先在肿瘤组织中积累,支持其有效递送和肿瘤靶向能力。在EGFR突变的临床前模型中,具有pH响应性NP的CD73抑制剂递送优于传统递送方法,通过增强DC成熟和效应T细胞浸润显着重塑免疫抑制性TME,这在与免疫疗法联合使用时特别有效。
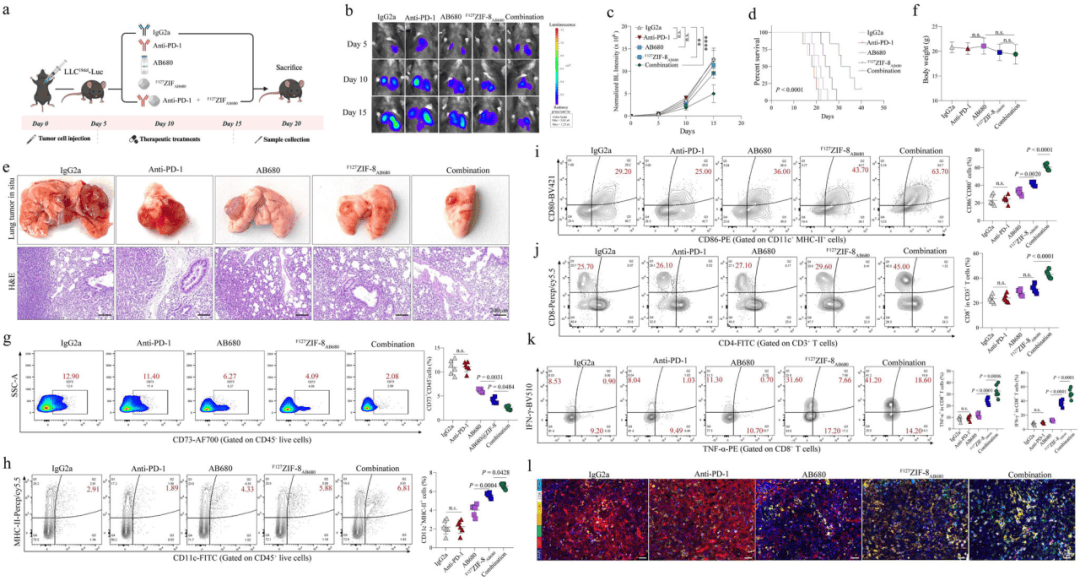 图5 在EGFR突变肺癌小鼠模型中的抗肿瘤作用及免疫调节
图5 在EGFR突变肺癌小鼠模型中的抗肿瘤作用及免疫调节
文章小结
这项研究证明了EGFR驱动的CD73上调促进腺苷积累,腺苷是一种抑制CD8 T细胞成熟的因子,从而削弱其启动CD8 T细胞和启动强健抗肿瘤免疫反应的能力。针对该通路进行pH响应型纳米颗粒,有效减轻了酸性TME中腺苷的产生,从而增强了DC功能和CD8 T细胞反应,凸显了克服EGFR突变NSCLC免疫治疗耐药性的一种有前途的治疗方法(图6)。
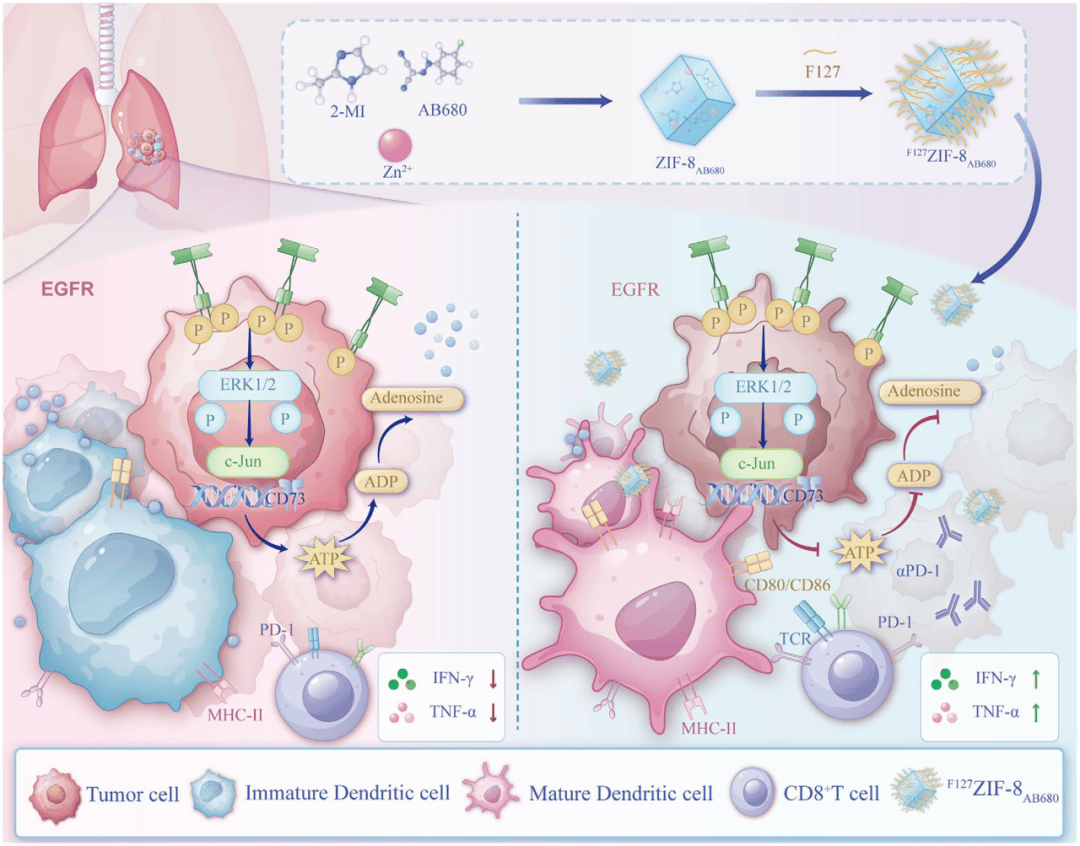 图6 机制图
图6 机制图
拜谱小结
该研究阐述了新型纳米药物克服EGFR介导的DC细胞障碍并增强突变型NSCLC的抗肿瘤免疫力。拜谱生物为该研究提供了医学广靶MT1000代谢组学技术方法,拜谱生物可提供完善成熟的蛋白质组学、修饰蛋白质组学、代谢组学、转录组学等多组学产品技术服务体系。针对医学研究方向,拜谱生物推出多种特色靶向代谢组产品,如QMT1000医学绝对定量靶向代谢组学(MT1000升级版)、MLT4500医学高通量靶向脂质组、CC100(中心碳代谢)靶向代谢组等,助力高分文章发表,欢迎咨询!
参考文献
X. Shang, X. Geng, Z. Wang, et al. Overcoming EGFR-Mediated Dendritic Cell Dysfunction to Enhance Anti-tumor Immunity in EGFR-Mutant NSCLC by Precisely Targeting CD73 With pH-responsive Nanocarriers. Adv. Sci. (2025): e13182. https://doi.org/10.1002/advs. 20251318.