

抑制依赖性谷氨酰胺代谢是治疗三阴性乳腺癌(TNBC)饥饿的一种有效方法,但会受到补偿性糖酵解和传递效率不足的限制。
近日,西北工业大学医学研究院戴亮亮团队在Research发表了题为“Delivery-Graded Programmable Micelles Achieve Enhanced Tumor Starvation through Combined Glutamine Deprivation and Angiogenesis Inhibition”的研究论文。该研究构建了一种pH响应的尺寸/电荷重编程胶束,具有分层传递特性,用于通过谷氨酰胺耗竭和血管阻断来抑制TNBC,为实现高效的TNBC治疗提供了一种新思路。拜谱生物为该研究成果提供了MT1000靶向代谢组学服务。

英文标题:Delivery-Graded Programmable Micelles Achieve Enhanced Tumor Starvation through Combined Glutamine Deprivation and Angiogenesis Inhibition(Research IF:10.7)
中文标题:递送分级可编程胶束通过联合谷氨酰胺剥夺和血管生成抑制实现增强的肿瘤饥饿
客户单位:西北工业大学
研究材料:细胞和BALB/c裸鼠
拜谱提供技术:MT1000靶向代谢组
技术路线:
研究结果
1、PPD/PPQV@C纳米胶束的合成与表征
通过傅立叶变换红外光谱、透射电子显微镜、动态光散射等表征实验发现PPD/PPQV@C纳米胶束具有良好的生物稳定性、且对弱酸性肿瘤微环境具有响应性(可实现电荷转化、尺寸缩小及pH响应分级释放),有利于实现纳米系统顺利到达肿瘤部位发挥效用(图1A-F)。
 图1.PPD/PPQV@C胶束纳米体系的表征
图1.PPD/PPQV@C胶束纳米体系的表征
2、PPD/PPQV@C输送效能评估
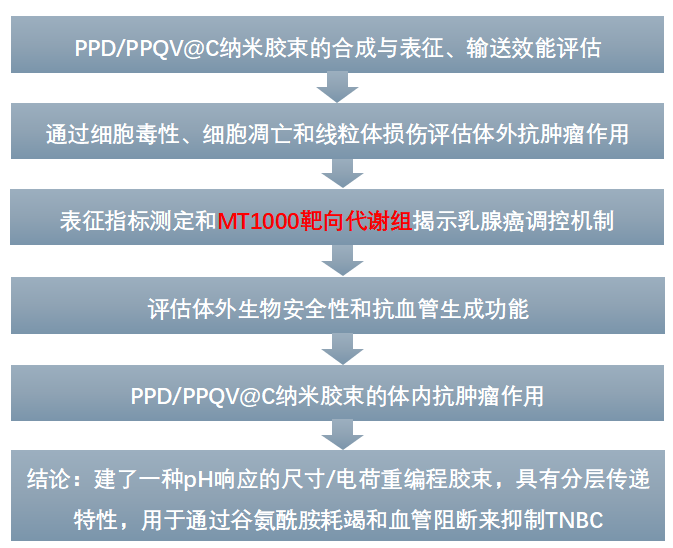
通过孵育等实验揭示PPD/PPQV@C胶束通过pH响应尺寸缩小、电荷逆转等特性可以有效地克服肿瘤组织、细胞吸收和溶酶体逃逸的生物屏障,从而提升其抗肿瘤疗效(图2A-E)。
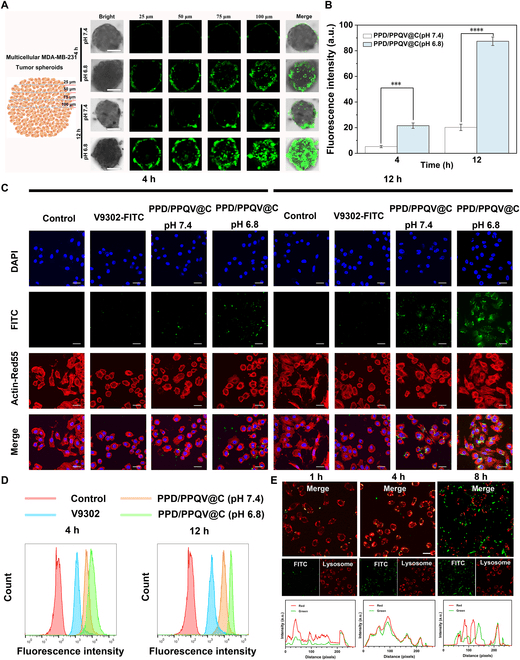 图2.PPD/PPQV@C胶束纳米系统对肿瘤穿透、内吞和溶酶体逃逸作用的评估
图2.PPD/PPQV@C胶束纳米系统对肿瘤穿透、内吞和溶酶体逃逸作用的评估
3、PPD/PPQV@C的体外抗肿瘤作用评估
通过评估PPD/PPQV@C的体外细胞毒性、细胞凋亡和线粒体损伤等指标揭示了PPD/PPQV@C纳米系统具有良好的体外抗肿瘤效果(图3A-E)。
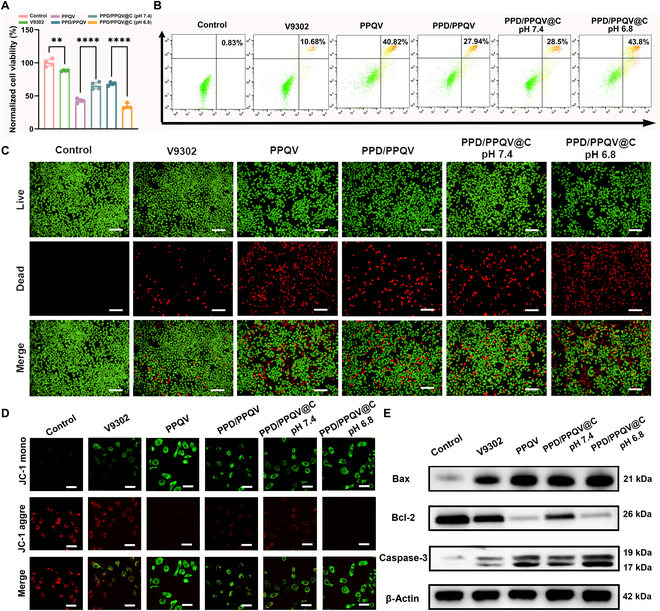 图3.体外细胞毒性、细胞凋亡和线粒体损伤评估
图3.体外细胞毒性、细胞凋亡和线粒体损伤评估
4、PPD/PPQV@C调控乳腺癌的机制解析
通过谷氨酰胺、GSH和氧化应激等表征指标测定实验揭示了PPD/PPQV@C通过抑制ASCT2转运体功能阻断TNBC细胞的谷氨酰胺摄取进而诱发肿瘤细胞的饥饿(图4A-F)。
 图4.纳米系统体外肿瘤杀伤机制评估
图4.纳米系统体外肿瘤杀伤机制评估
进一步通过靶向代谢组学证实了PPD/PPQV@C可以有效阻断谷氨酰胺代谢,抑制肿瘤细胞的依赖核苷酸合成、氨基酸代谢和能量供应(图5D-E)。
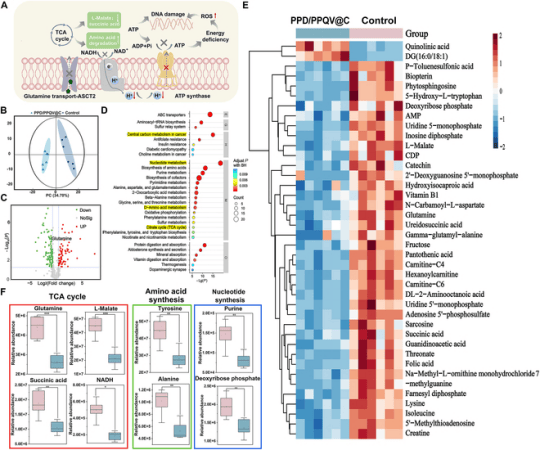 图5.MT1000代谢组学分析
图5.MT1000代谢组学分析
5、评估体外生物安全性和抗血管生成功能
通过FITC标记等实验发现CA4P在纳米系统中的核心功能是通过抑制微管蛋白聚合和细胞周期停止G₂/M期有丝分裂停滞来特异性抑制血管生成,内皮细胞在ECM中从纳米系统中有选择地释放,具有良好的生物安全性(图6A-H)。
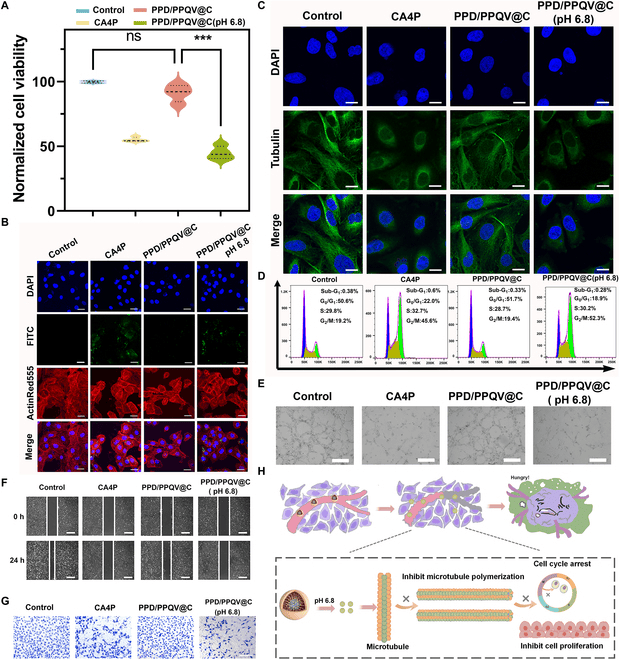 图6.纳米系统的体外抗血管生成研究
图6.纳米系统的体外抗血管生成研究
6、PPD/PPQV@C纳米胶束的体内抗肿瘤作用
小鼠模型的肝肾功能指数、肿瘤体积等实验结果表明PPD/PPQV@C纳米胶束通过分层输送和pH响应大小/电荷转换策略显著提高CA4P和V9302的生物利用度,并通过双阻断与谷氨酰胺缺乏和血管生成抑制相结合,进而抑制肿瘤生长(图7A-H)。
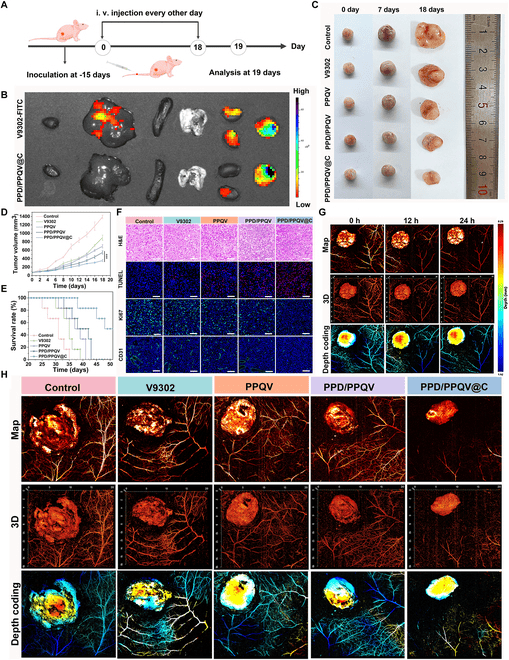 图7.体内抗肿瘤作用评估
图7.体内抗肿瘤作用评估
文章小结
总之,本研究阐明了PPD/PPQV@C纳米胶束通过分级递送和pH响应的尺寸/电荷转换策略显著提高了CA4P和V9302的生物利用度,并通过双重阻断结合谷氨酰胺剥夺和血管生成抑制,抑制了肿瘤生长,延长了生存时间,为高效的TNBC治疗提供了一个智能纳米平台(图8)。
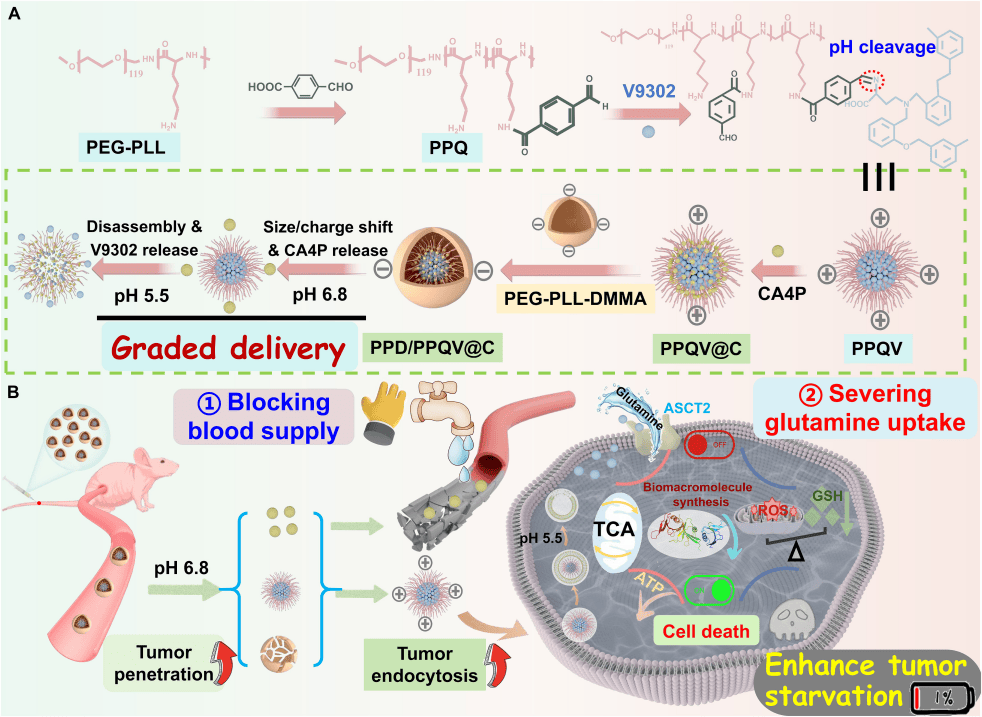 图8.PPD/PPQV@C胶束纳米系统的构建及其抗肿瘤治疗效能
图8.PPD/PPQV@C胶束纳米系统的构建及其抗肿瘤治疗效能
拜谱小结
本研究全面解析了PPD/PPQV@C纳米胶束在抗肿瘤作用机制。拜谱生物为其提供了MT1000靶向代谢组检测分析服务。拜谱生物建立了完善成熟的转录组学、蛋白组学、翻译后修饰组、代谢组学以及多组学联合产品技术服务体系。针对医学研究方向,拜谱生物推出多种特色靶向代谢组产品,如QMT1000医学绝对定量靶向代谢组学、MLT4500医学高通量靶向脂质组、CC100(中心碳代谢)靶向代谢组等,助力高分文章发表,欢迎咨询!
参考文献:
Wei X, Cheng J, Geng M, et al. Delivery-Graded Programmable Micelles Achieve Enhanced Tumor Starvation through Combined Glutamine Deprivation and Angiogenesis Inhibition. Research (Wash D C). 2025;5:0858. Published 2025 Sep 5. doi:10.34133/research.0858