

肿瘤微环境(TME)通过提供关键代谢产物来支持癌细胞的存活与发生发展。脂肪细胞通过分泌游离脂肪酸(FFAs)和脂肪因子促进肿瘤进展。然而,脂滴(LD)从脂肪细胞中释放的作用和机制仍不明确。
近期,南通大学附属医院游波团队在Cancer & Metabolism上发表题为“Improved VPS4B O-GlcNAc modification triggers lipid droplets transferring from adipocytes to nasopharyngeal carcinoma cells”的论文。首次系统阐明了缺氧鼻咽癌(NPC)细胞通过外泌体介导的VPS4B-ANXA5轴驱动脂肪细胞LD释放的全新机制,揭示了肿瘤微环境中脂滴转移的关键机制,为鼻咽癌治疗提供了新的潜在途径。拜谱生物为该研究成果提供转录组学检测分析服务。

英文标题:Improved VPS4B O-GlcNAc modification triggers lipid droplets transferring from adipocytes to nasopharyngeal carcinoma cells(Cancer & Metabolism IF:6.0)
中文标题:增强的VPS4B O-GlcNAc修饰引发脂滴从脂肪细胞向鼻咽癌细胞的转移
客户单位:南通大学附属医院
研究材料:细胞
拜谱提供技术:转录组学
技术路线:

研究结果
脂肪细胞来源的LD促进NPC恶性表型
通过超滤分离实验首次证实NPC细胞优先摄取>100kDa的组分(含LD),而<100kDa的组分(含FFA)作用微弱(图1 A-C)。LD以浓度依赖性方式增强NPC细胞的增殖和迁移能力(图1 D-I)。
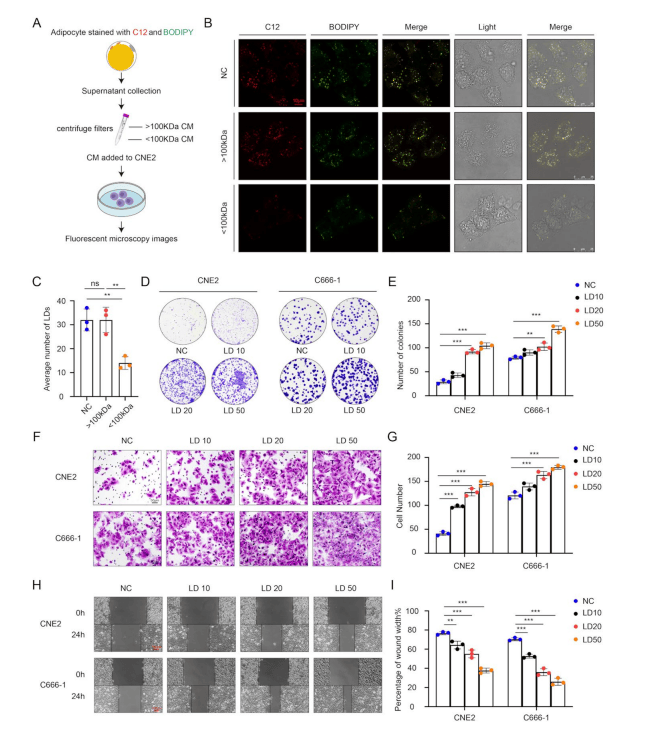 图1 脂肪细胞来源的LD促进NPC恶性表型
图1 脂肪细胞来源的LD促进NPC恶性表型
缺氧NPC细胞通过巨胞饮作用摄取LD
体外模拟实验结果显示,EIPA(一种巨胞饮作用抑制剂)对LD摄取的抑制作用更强,添加EIPA可逆转LD促进的鼻咽癌细胞增殖(图2 A-E)。此外,裸鼠的肿瘤异种移植模型显示,EIPA在稳定脂肪细胞来源的LD引起的肿瘤生长方面具有类似的抑制作用(图2 F-J)。
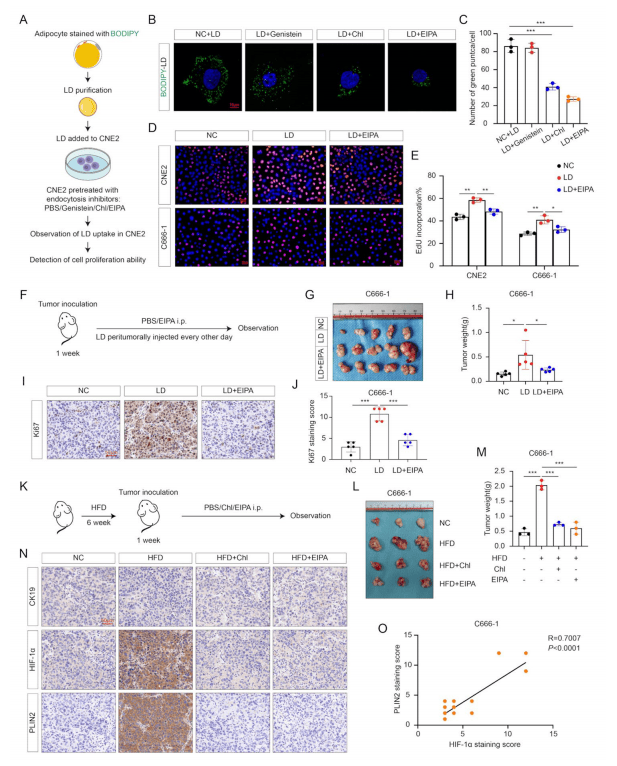 图2 缺氧NPC细胞通过巨胞饮作用摄取LD
图2 缺氧NPC细胞通过巨胞饮作用摄取LD
缺氧NPC的外泌体诱导脂肪细胞释放LD
建立体外模型以验证外泌体在脂肪细胞与NPC代谢共生中的作用。结果显示,缺氧NPC的外泌体(H-exo)促进了脂肪细胞释放LD(图3 B-E)。经H-exo预处理的脂肪细胞上清液,能使NPC细胞的LD摄取量增加约1.6倍(p<0.01),表明H-exo诱导释放的LD可被NPC有效利用(图3 J-L)。
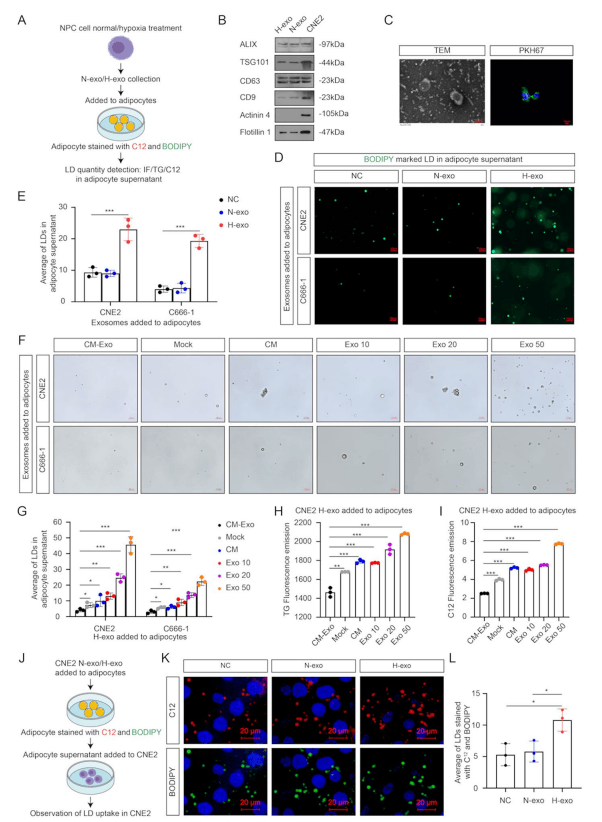 图3 缺氧NPC的外泌体诱导脂肪细胞释放LD
图3 缺氧NPC的外泌体诱导脂肪细胞释放LD
ATP酶VPS4B参与脂肪细胞LD释放
细胞膜流动性的变化通常与细胞内容物的释放有关,缺氧外泌体对脂肪细胞膜流动性的影响在孵育6小时后显现。对经N-exo(常氧NPC细胞的外泌体)和H-exo预处理的脂肪细胞进行转录组学测序,结果显示,31种ATP酶在H-exo处理的脂肪细胞中高表达,其中VPS4B(AAA ATPase家族成员)的mRNA和蛋白水平显著上调(1.8倍,p<0.01),表明VPS4B是参与脂滴释放的关键信号蛋白(图4 B-F)。加入VPS4B抑制剂可减少H-exo刺激的脂肪细胞释放LD(图4 H-P)。
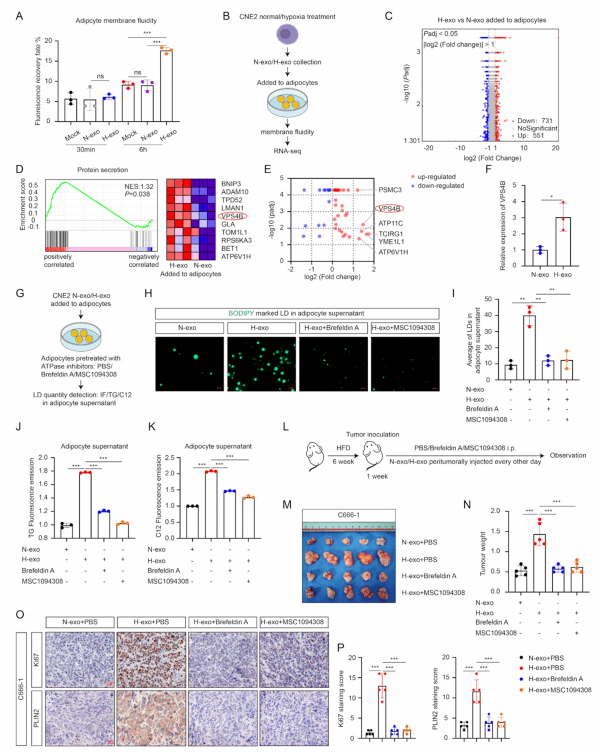 图4 ATP酶VPS4B参与脂肪细胞LD释放
图4 ATP酶VPS4B参与脂肪细胞LD释放
ANXA5与VPS4B相互作用协同促进LD释放
对照组和VPS4B过表达组脂肪细胞的免疫共沉淀产物进行测序分析,发现ANXA5等5个膜修复蛋白是VPS4B的关键相互作用蛋白(图5 A-C)。转录组学结果显示ANXA5呈高表达状态,与此一致的是,H-exo中ANXA5含量显著高于N-exo(图5 D-E)。VPS4B通过ATP酶结构域与ANXA5结合发生相互作用,ANXA5过表达可增强VPS4B介导的LD释放,进而促进NPC细胞迁移(图5 F-H)。
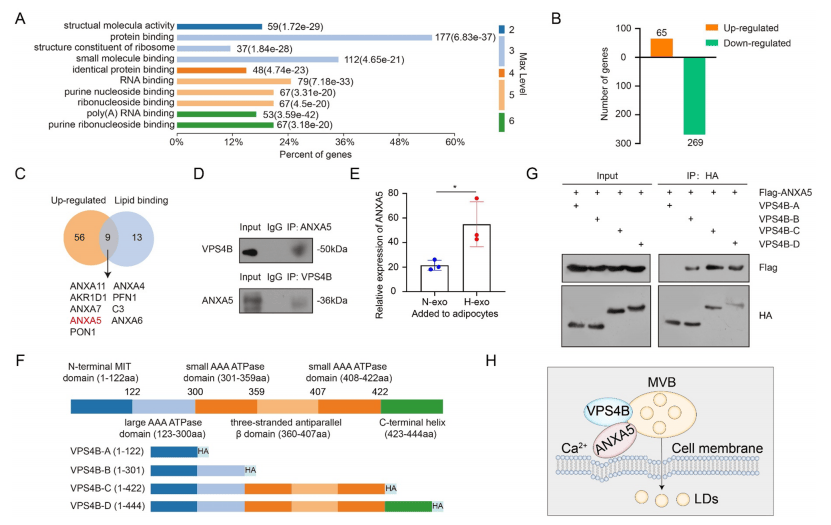 图5 ANXA5与VPS4B相互作用协同促进LD释放
图5 ANXA5与VPS4B相互作用协同促进LD释放
VPS4B发生O-GlcNAc修饰,促进LD释放
KEGG分析显示,H-exo抑制脂肪细胞中LKB1-AMPK通路,激活HBP通路,促进UDP-GlcNAc生成(图6 A-G)。UDP-GlcNAc增强VPS4B的O-GlcNAc修饰,维持其蛋白稳定性,进而增强与ANXA5的相互作用(图6 H-K)。
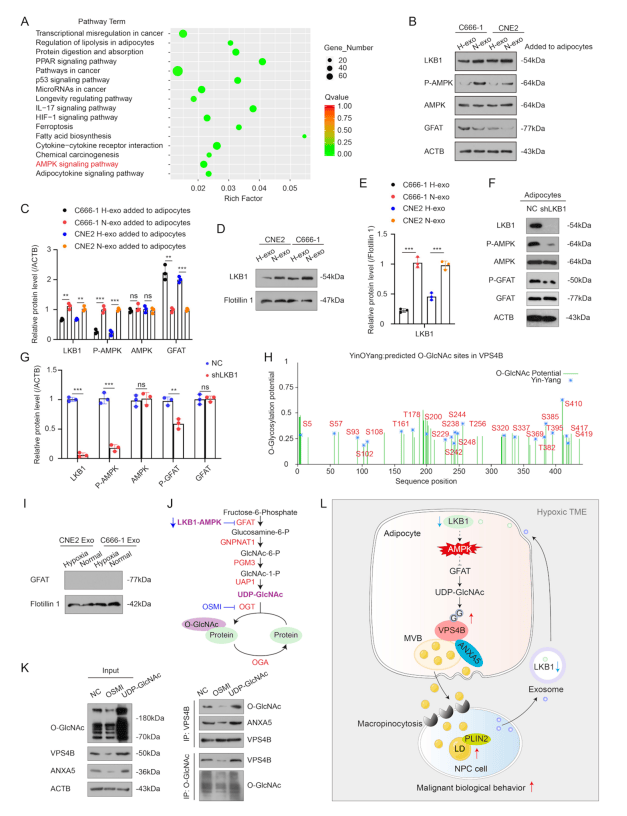 图6 VPS4B发生O-GlcNAc修饰,促进LD释放
图6 VPS4B发生O-GlcNAc修饰,促进LD释放
文章小结
本研究发现缺氧NPC细胞通过H-exo中低表达的LKB1抑制LKB1-AMPK通路,激活HBP通量,进而增强VPS4B的O-GlcNAc修饰。转录组学和互作蛋白组分析显示,修饰后的VPS4B通过与ANXA5相互作用触发LD释放,体内实验验证了靶向VPS4B或LD摄取可抑制NPC进展。这一发现为靶向LD转移的NPC治疗提供了VPS4B O-GlcNAc修饰这一全新靶点(图7)。
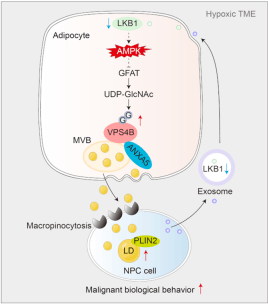 图7 鼻咽癌细胞与脂肪细胞通过外泌体和LD形成代谢共生关系机制图
图7 鼻咽癌细胞与脂肪细胞通过外泌体和LD形成代谢共生关系机制图
拜谱小结
该研究首次系统阐明了NPC细胞通过外泌体介导的VPS4B-ANXA5轴驱动脂肪细胞LD释放的全新机制,揭示了肿瘤微环境中脂滴转移的关键机制,为鼻咽癌治疗提供了新的潜在途径。拜谱生物为其提供了转录组学检测分析服务。拜谱生物作为一家国内领先的多组学服务公司,已研发完成并建立了完善成熟的转录组学、蛋白质组学、修饰蛋白组学、代谢组学以及多组学联合产品技术服务体系,助力发表高分文献,欢迎致电咨询!
参考文献:
Yin H, Shan Y, Zhu Q, et al. Improved VPS4B O-GlcNAc modification triggers lipid droplets transferring from adipocytes to nasopharyngeal carcinoma cells.Cancer Metab. 2025;13(1):24. Published 2025 May 23. doi:10.1186/s40170-025-00393-3