

肝癌(HCC)是常见且致命的恶性肿瘤,多数患者确诊时已至晚期,现有靶向治疗药物存在耐药问题,亟需新的治疗靶点和策略。circRNAs 参与肿瘤发生发展,但其在肝癌中的作用机制尚未完全明确。
南京医科大学第一附属医院王学浩院士团队杨世坤等人在Advanced Science(IF:14.3)上发表了题为“EIF4A3-Mediated Biogenesis of CircFADS1 Promotes the Progression of Hepatocellular Carcinoma via Wnt/β-Catenin Pathway”的研究性论文。本研究揭示了circFADS1调控GSK3β的功能,从而影响肝细胞癌的进展。EIF4A3/circFADS1/GSK3β/β-catenin轴有望成为肝细胞癌的新治疗靶点,同时circFADS1也是仑伐替尼耐药的重要因素。拜谱生物为该研究成果提供了转录组学检测分析服务。

英文标题:EIF4A3-Mediated Biogenesis of CircFADS1 Promotes the Progression of Hepatocellular Carcinoma via Wnt/β-Catenin Pathway(Advanced Science IF:14.3)
中文标题:EIF4A3介导的CircFADS1生物发生通过Wnt/β-catenin途径促进肝细胞癌的进展
发表时间:2025年2月
客户单位:南京医科大学第一附属医院
研究材料:肝癌细胞
拜谱提供技术:转录组学
技术路线:
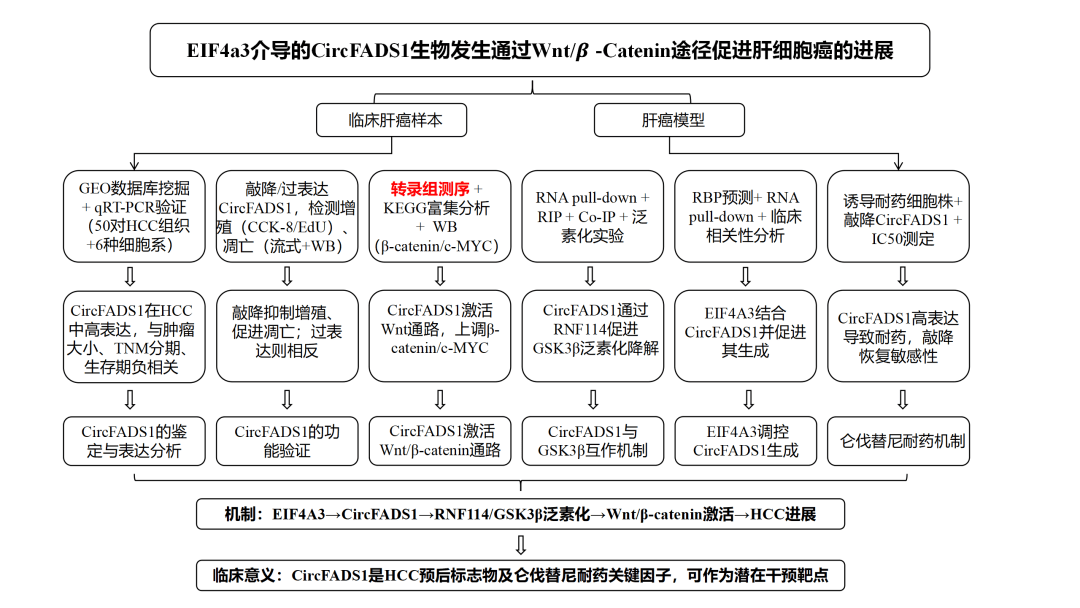
研究结果
01、肝癌中CircFADS1的识别与表征
50对HCC及其相邻非肿瘤组织临床数据表明CircFADS1在肿瘤中显著过表达(图1 A-D),HepG2细胞表现出最高的CircFADS1表达水平(图1 E-H),主要定位于HCC细胞的细胞质中(图1 I-J)。
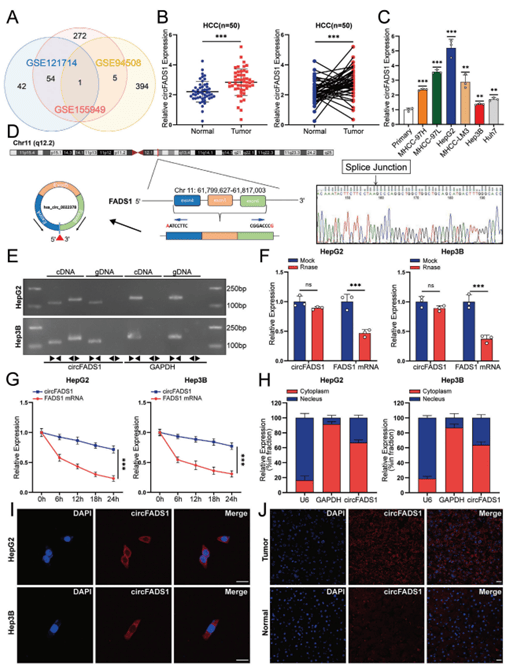 图1 CircFADS1的鉴定及特征
图1 CircFADS1的鉴定及特征
02、CircFADS1促进HCC细胞增殖,抑制体外凋亡
建立敲低细胞系以及过表达CircFADS1的稳定细胞系,CircFADS1敲低显著抑制了HCC细胞的增殖,表明CircFADS1增强了HCC细胞的增殖并抑制了其凋亡(图2A-G)。
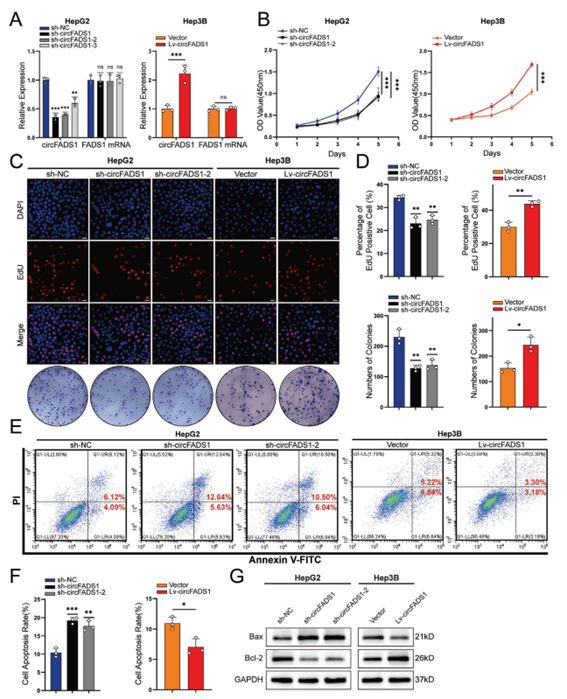 图2 CircFADS1在HCC体外的作用
图2 CircFADS1在HCC体外的作用
03、CircFADS1参与Wnt/β-Catenin通路
转录组测序等实验验证显示,CircFADS1 与 Wnt/β-Catenin 通路相关,可调节该通路关键蛋白 β-Catenin 和下游 c-MYC 的表达(图3A-C),进而影响肝癌细胞的增殖和凋亡,还可能调节抗肿瘤免疫反应。
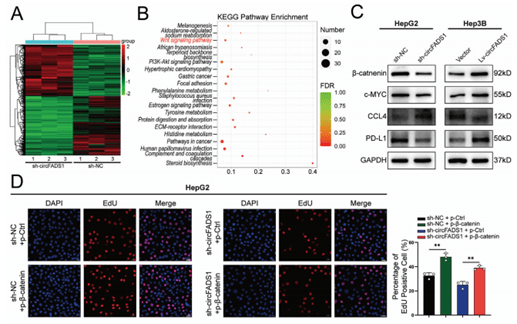 图3 CircFADS1通过失活Wnt/β-catenin通路介导对HCC的致癌作用
图3 CircFADS1通过失活Wnt/β-catenin通路介导对HCC的致癌作用
04、HCC细胞中CircFADS1与GSK3β相互作用
利用RNA pull-down实验和质谱分析等方法鉴定CircFADS1相互作用蛋白(图4A-H),结果表明CircFADS1 通过泛素化介导的降解来抑制肝癌细胞中 GSK3β 蛋白的水平。
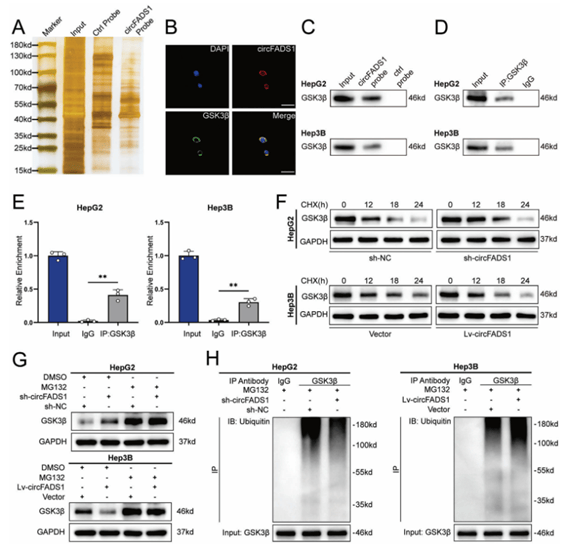 图4 CircFADS1与GSK3β相互作用,促进其泛素化
图4 CircFADS1与GSK3β相互作用,促进其泛素化
05、GSK3β被RNF114泛素化并受到CircFADS1调控
免疫荧光显示,RNF114与GSK3β和CircFADS1共定位在细胞质中(图5A-B),CircFADS1 能与 GSK3β 结合,促进其泛素化和降解,且通过招募 E3 泛素连接酶 RNF114 增强这种作用,而 GSK3β 作为 CircFADS1 的下游效应器,参与调控肝癌细胞的生长和凋亡 。
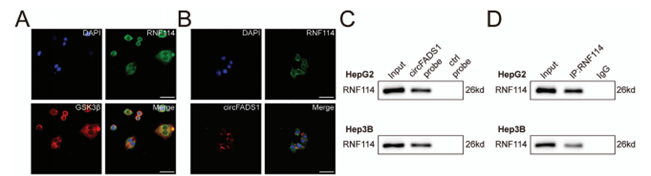 图5 RNF114作为GSK3β的特异性E3泛素连接酶,而CircFADS1促进它们的相互作用
图5 RNF114作为GSK3β的特异性E3泛素连接酶,而CircFADS1促进它们的相互作用
06、EIF4A3促进CircFADS1的生物合成的影响
作者证明EIF4A3与CircFADS1具有最多的结合位点(图6A),RIP证明EIF4A3可以结合到CircFADS1的下游位点,并且EIF4A3表达水平不受CircFADS1调控。WB结果显示EIF4A3过表达降低了GSK3β的表达并增加了β-catenin和c-MYC的水平(图6E),EIF4A3的过表达促进HepG2细胞的增殖并抑制了凋亡,这些效应可以通过CircFADS1的敲低来逆转。
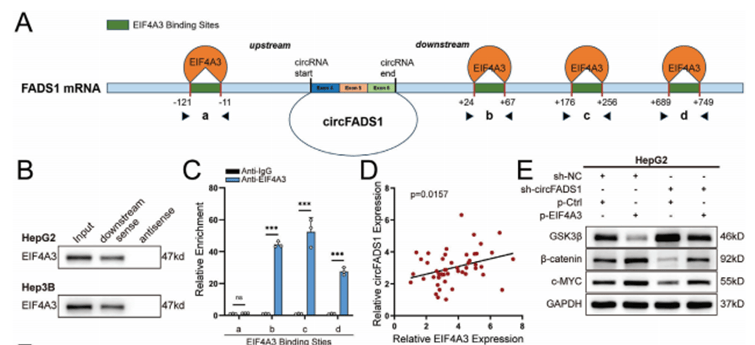 图6 EIF4A3显著增强了CircFADS1的表达
图6 EIF4A3显著增强了CircFADS1的表达
07、CircFADS1促进HCC细胞在体内的生长
敲低CircFADS1的HepG2细胞形成的皮下肿瘤在大小或质量上均显著小于对照组(图7A),过表达CircFADS1的Hep3B细胞则表现出促进皮下肿瘤生长的明显效果。
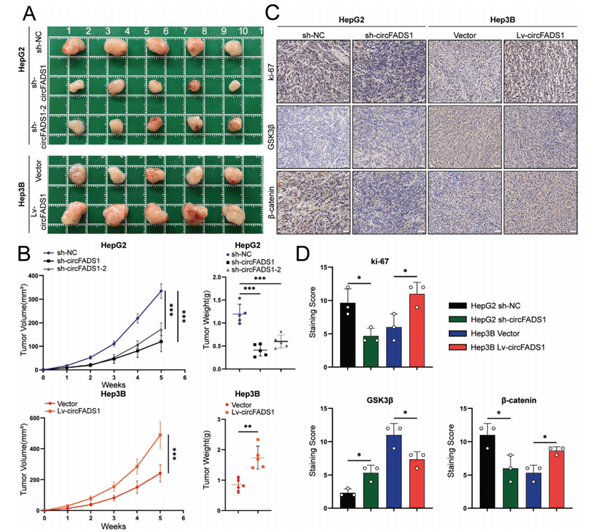 图7 CircFADS1加速HCC细胞的体内生长
图7 CircFADS1加速HCC细胞的体内生长
08、CircFADS1促进Lenvatinib的耐药性
CCK-8实验显示耐药细胞系的半抑制浓度显著高于亲本细胞系,CircFADS1在耐药细胞系中的表达显著更高(图8A-B)。CCK-8、克隆存活实验和流式细胞术显示CircFADS1的表达与Lenvatinib耐药相关(图8C)。体内实验也证明CircFADS1是促进HCC中lenvatinib耐药的关键因素。
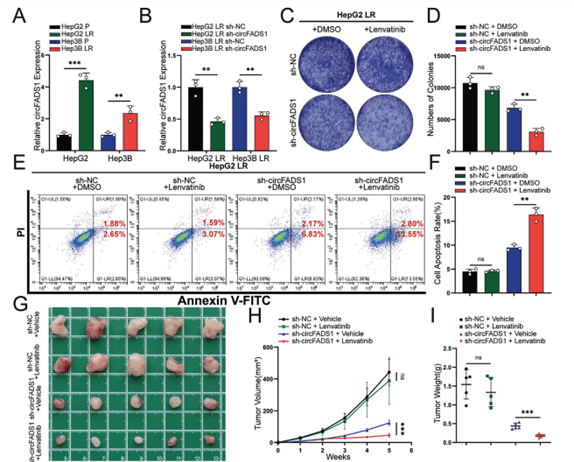 图8 CircFADS1与lenvatinib耐药密切相关
图8 CircFADS1与lenvatinib耐药密切相关
文章小结
本研究旨在揭示新型环状 RNA(circRNA)CircFADS1影响肝细胞癌(HCC)进展的机制(图9)。CircFADS1在HCC中表达升高,并与不良预后相关。功能上,CircFADS1过表达通过诱导HCC细胞增殖和抑制细胞凋亡来加速HCC进展。机制上,RNA-seq分析表明其与Wnt/β-catenin通路有关。此外,CircFADS1与GSK3β相互作用,并通过招募泛素连接酶RNF114促进其泛素化和降解,而 EIF4A3则促进CircFADS1的生物合成。另外,CircFADS1 与仑伐替尼耐药性密切相关。
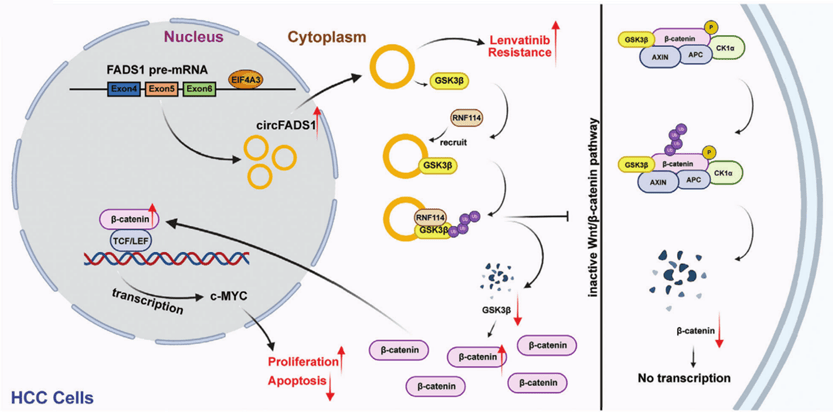 图9 肝癌细胞中 circFADS1 作用机制的示意图
图9 肝癌细胞中 circFADS1 作用机制的示意图
拜谱小结
本研究揭示了CircFADS1调节GSK3β功能,影响肝细胞癌的进展,并证明EIF4A3/CircFADS1/GSK3β/β-catenin轴有望成为肝细胞癌的新型治疗靶点。拜谱生物为其提供了转录组学检测分析服务。拜谱生物建立了完善成熟的转录组学、蛋白组学、修饰蛋白组学、代谢组学以及多组学联合产品技术服务平台,助力发表高分文献,欢迎致电咨询!
参考文献:
[1]Tang L, Ji Y, Ni C, et al. EIF4A3-Mediated Biogenesis of CircFADS1 Promotes the Progression of Hepatocellular Carcinoma via Wnt/β-Catenin Pathway. Adv Sci (Weinh). 2025;12(14):e2411869. doi:10.1002/advs.202411869