

棕榈酰化修饰,作为一种关键的蛋白质翻译后修饰(PTM),通过棕榈酸共价连接到蛋白质的半胱氨酸残基上,对蛋白质的功能和细胞信号传导产生深远影响。自20世纪70年代被发现以来,棕榈酰化修饰在细胞生物学和疾病发生中的重要性逐渐被认识。它在细胞增殖、分化、凋亡以及免疫应答、神经传递等多种生物过程中发挥着关键作用。例如,棕榈酰化修饰与癌症、神经退行性疾病和代谢性疾病等疾病的发生和发展密切相关,影响着疾病的进程。针对棕榈酰化修饰过程的酶和蛋白质已成为潜在的治疗靶点,开发针对这些靶点的小分子抑制剂,有望为治疗相关疾病提供新的策略。棕榈酰化修饰的研究还有助于揭示细胞内复杂的生物学机制,通过研究特定蛋白质的棕榈酰化修饰如何影响其功能和细胞命运,可以深入理解细胞分化和发育的调控网络。因此,棕榈酰化修饰在生物医学研究中具有重要价值,它不仅为疾病机制的理解提供了新的视角,还为疾病的诊断、治疗和预防提供了潜在的新策略。
2024年棕榈酰化修饰研究进展
在2024年,棕榈酰化修饰领域的研究取得了显著进展。我们统计了2024年影响因子超过10分的棕榈酰化研究论文共44篇,这些研究不仅涉及棕榈酰化修饰在免疫、肿瘤、代谢疾病中的作用,还包括其在免疫调节、细胞信号传导等多个医学方向的新发现,为未来的研究方向提供了新的思路(图1和表1)。
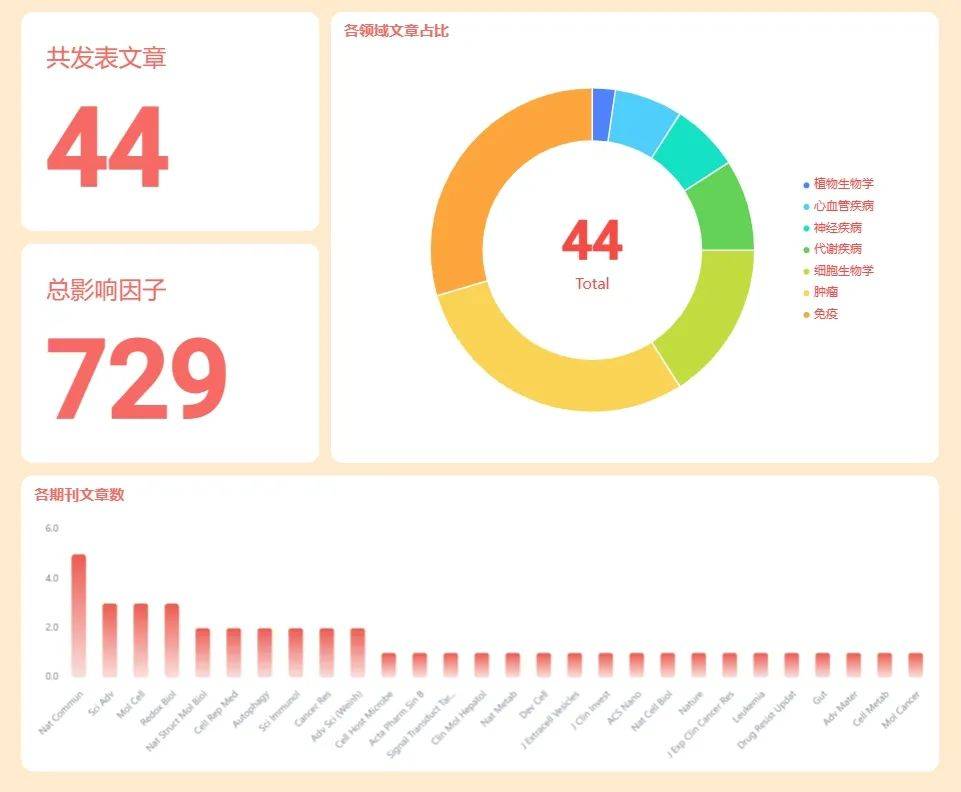 图1 2024年棕榈酰化文章总汇(IF>10)
图1 2024年棕榈酰化文章总汇(IF>10)
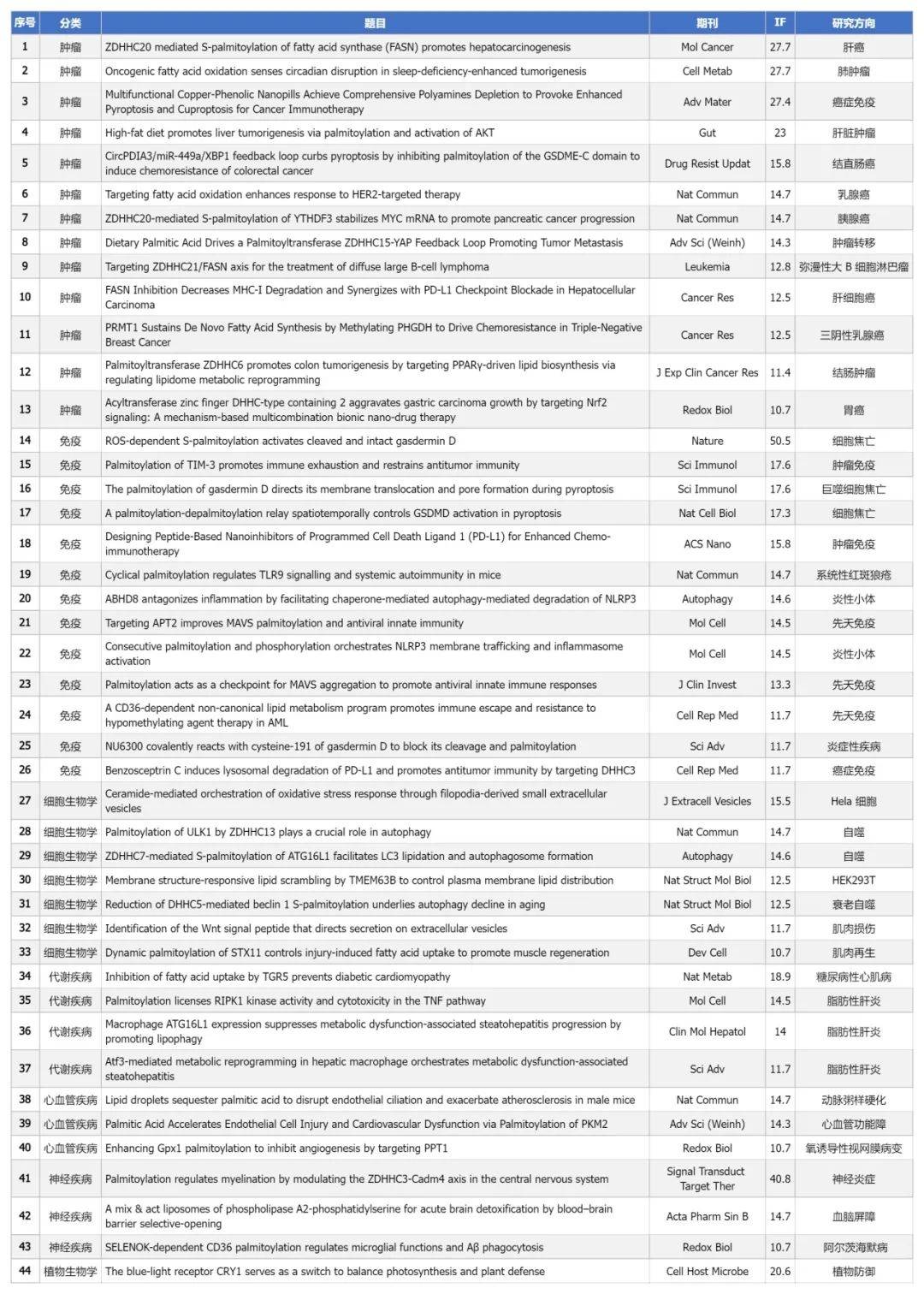 表1 2024年棕榈酰化文章总汇(IF>10)
表1 2024年棕榈酰化文章总汇(IF>10)
多组学联合方案在棕榈酰化修饰研究中的应用
对于棕榈酰化的研究,我们也可以结合多组学的思路进行探讨。
非靶代谢组学/靶向中长链脂肪酸探寻底物棕榈酸水平的变化
棕榈酸是一种常见的饱和脂肪酸,在细胞膜的构成和代谢中起着重要作用。细胞内棕榈酸水平的变化会影响蛋白质棕榈酰化修饰的底物供应,从而影响蛋白质的性质和功能。在某些病理状态下,如糖尿病或肥胖,细胞内棕榈酸水平可能会异常升高,导致蛋白质棕榈酰化水平的增加,进而影响蛋白质的功能和细胞信号传导。研究底物棕榈酸水平的变化有助于理解棕榈酰化修饰在生理和病理状态下的调控机制,以及如何通过调节棕榈酸水平来影响棕榈酰化修饰,从而为疾病治疗提供新的策略。
比如中山大学发表在Advanced Science上的“Palmitic Acid Accelerates Endothelial Cell Injury and Cardiovascular Dysfunction via Palmitoylation of PKM2”文章,发现了高水平的棕榈酸(PA)与心血管疾病风险增加相关,其机制在于PA促进血管内皮细胞中糖酵解限速酶PKM2的Cys31位点棕榈酰化。PKM2-C31棕榈酰化抑制PKM2四聚化和酶活性,进而抑制内皮糖酵解,导致内皮功能障碍和心血管疾病发生。zDHHC13和APT2参与调节PKM2的棕榈酰化。这些发现揭示了蛋白质棕榈酰化在PA诱导的心血管功能障碍中的关键作用,并为心血管疾病的预防和治疗提供了新的思路。

定量蛋白质组学和转录组学确定棕榈酰基转移酶水平的变化
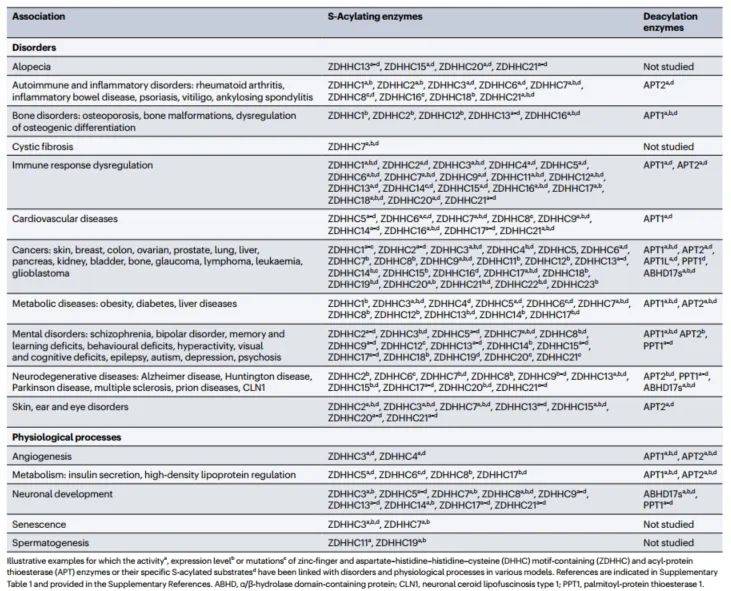
棕榈酰基转移酶是催化蛋白质棕榈酰化修饰的关键酶,它通过将棕榈酸转移到蛋白质特定氨基酸残基上,从而改变蛋白质的性质。棕榈酰基转移酶的表达和活性在多种疾病中发生改变,例如,在某些癌症中,棕榈酰基转移酶的表达上调可能会导致蛋白质棕榈酰化水平的增加,从而促进肿瘤的生长和转移。研究棕榈酰基转移酶水平的变化有助于揭示棕榈酰化修饰的调控机制,以及如何通过调控棕榈酰基转移酶的表达和活性来影响棕榈酰化修饰。这为开发针对棕榈酰化修饰的药物提供了新的靶点。
表2 棕榈酰基转移酶与疾病或生理过程之间的关系 (图源:Mesquita et al., Nat Rev Mol Cell Biol, 2024)
比如重庆大学肿瘤医院和复旦大学联合发表在Molecular Cancer上的“ZDHHC20 mediated S-palmitoylation of fatty acid synthase (FASN) promotes hepatocarcinogenesis”文章(拜谱项目文章),研究了棕榈酰基转移酶ZDHHC20在肝癌发生发展中的作用机制。研究发现,ZDHHC20缺失可以显著降低化学诱导的小鼠肝癌发生率。进一步分析发现,ZDHHC20通过在脂肪酸合成酶(FASN)的特定半胱氨酸残基上催化S-棕榈酰化,从而稳定FASN蛋白,抑制其泛素-蛋白酶体途径介导的降解。ZDHHC20缺失或抑制,以及FASN关键半胱氨酸位点的突变,均可加速FASN的降解。此外,ZDHHC20介导的FASN棕榈酰化通过E3泛素连接酶复合物SNX8-TRIM28与泛素化途径竞争。该研究结果揭示了ZDHHC20在促进肝癌发生发展中的关键作用,以及蛋白质棕榈酰化和泛素化修饰之间相互限制的机制。

其他翻译后修饰crosstalk
棕榈酰化修饰与磷酸化、泛素化等其他蛋白质修饰之间存在着错综复杂的相互作用,这些相互作用对于蛋白质的功能调控和细胞信号传导具有重大的影响。磷酸化修饰通过改变蛋白质的电荷和空间结构,可能影响其与棕榈酰基转移酶的相互作用,进而调节棕榈酰化修饰的水平。反之,棕榈酰化修饰通过调整蛋白质的膜定位,也可能改变其在细胞内的磷酸化状态。在某些信号传导通路中,磷酸化可能激活蛋白质,而棕榈酰化则可能促进其定位到细胞膜上,从而发挥其生物学作用。泛素化修饰,通常作为蛋白质降解的标记,与影响蛋白质膜定位的棕榈酰化修饰之间可能存在相互竞争的关系。例如,泛素化可能促进棕榈酰化蛋白的降解,而棕榈酰化修饰也可能影响泛素化蛋白的稳定性。在某些情况下,泛素化和棕榈酰化可能共同参与信号传导过程,如细胞凋亡或炎症反应,它们之间的相互作用不仅影响单个蛋白质的功能,还可能对整个信号传导网络和细胞代谢过程产生深远影响。深入研究这些修饰之间的相互作用,有助于我们揭示细胞内复杂的调控机制,为疾病治疗提供新的策略和靶点。通过理解这些修饰如何协同或拮抗地调控蛋白质活性和定位,科学家们可以更精确地干预疾病相关途径,开发出更为精准的治疗方案。
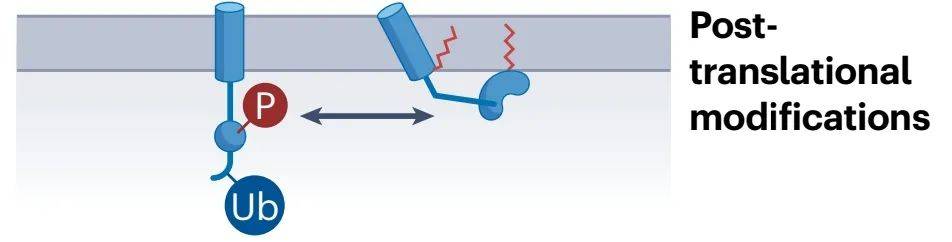 图2 棕榈酰化修饰crosstalk
图2 棕榈酰化修饰crosstalk
(Mesquita et al., Nat Rev Mol Cell Biol, 2024)
比如中国科学院合肥物质院发表在Neuro-Oncology上的“Oct4A palmitoylation modulates tumorigenicity and stemness in human glioblastoma cells”文章,发现,Oct4A的棕榈酰化修饰对于维持其蛋白稳定性和胶质母细胞瘤干细胞(GSC)的致瘤性至关重要。棕榈酰化修饰由ZDHHC17介导,可以防止Oct4A被溶酶体降解,并促进Oct4A与Sox4在SOX2增强子区域形成复合物,从而维持GSCs的干性。此外,研究还发现非棕榈酰化的Oct4A Cys198A突变体降解速度更快,表明棕榈酰化可能通过影响Oct4A的磷酸化状态来调节其稳定性,Oct4A的稳定性可能受到其棕榈酰化和磷酸化状态的共同调节。因此,Oct4A棕榈酰化修饰可能是治疗胶质母细胞瘤的潜在靶点。

最后,我们结合多组学和湿实验,总结一个棕榈酰化研究的整体研究方案,以飨读者(图3)。
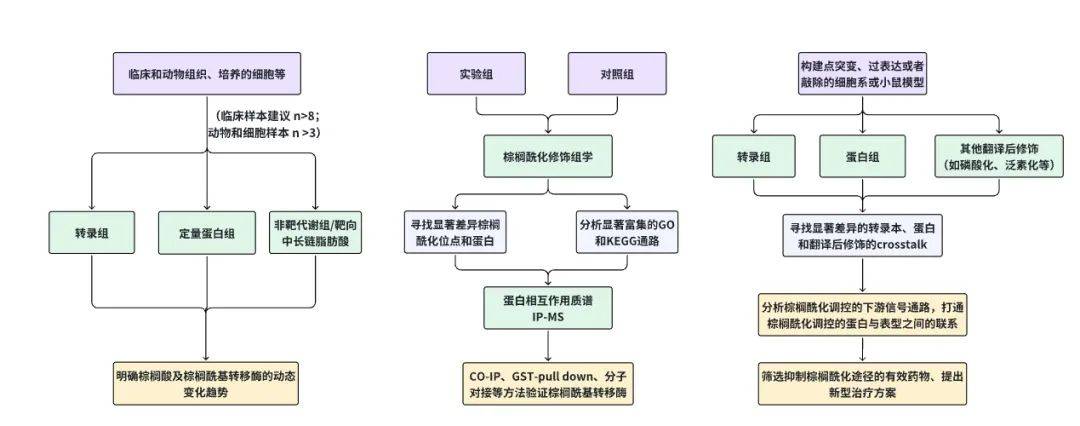 图3 棕榈酰化修饰的整体研究方案
图3 棕榈酰化修饰的整体研究方案
拜谱小结
棕榈酰化是重要的脂质化修饰形式,一般发生在半胱氨酸残基上。棕榈酰化修饰最重要的功能是增强可通行蛋白与膜的亲和性,从而调控蛋白质的定位与功能。拜谱作为国内领先的多组学服务公司,可提供基因组、转录组、蛋白组、代谢组等多组学服务。围绕半胱氨酸氧化还原修饰,拜谱生物可提供产品最全面、技术体系最成熟的氧化还原修饰系列产品,包括棕榈酰化、亚硝基化、谷胱甘肽化、硫巯基化、次磺酸化、total氧化还原、游离巯基,助力一系列文章发表。其中棕榈酰化修饰蛋白质组是我司首家推出、国内唯一成熟商业化的重磅特色产品,积累了丰富的项目经验,实现了在不同物种、不同模型、不同组织中的高效检出,棕榈酰化修饰位点平均检出量可达20000+,最高已突破40000+。欢迎大家咨询!
参考文献
[1] Chen X, Niu W, Fan X, Yang H, Zhao C, Fan J, Yao X, Fang Z. Oct4A palmitoylation modulates tumorigenicity and stemness in human glioblastoma cells. Neuro Oncol. 2023 Jan 5;25(1):82-96. doi: 10.1093/neuonc/noac157
[2] Ge X, He Z, Cao C, Xue T, Jing J, Ma R, Zhao W, Liu L, Jueraitetibaike K, Ma J, Feng Y, Qian Z, Zou Z, Chen L, Fu C, Song N, Yao B. Protein palmitoylation-mediated palmitic acid sensing causes blood-testis barrier damage via inducing ER stress. Redox Biol. 2022 Aug;54:102380. doi: 10.1016/j.redox.2022.102380
[3] Huang S, Guo Y, Li ZW, Shui G, Tian H, Li BW, Kadeerhan G, Li ZX, Li X, Zhang Y, Zhou T, You WC, Pan KF, Li WQ. Identification and Validation of Plasma Metabolomic Signatures in Precancerous Gastric Lesions That Progress to Cancer. JAMA Netw Open. 2021 Jun 1;4(6):e2114186. doi: 10.1001/jamanetworkopen.2021.14186
[4] He Y, Li S, Jiang L, Wu K, Chen S, Su L, Liu C, Liu P, Luo W, Zhong S, Li Z. Palmitic Acid Accelerates Endothelial Cell Injury and Cardiovascular Dysfunction via Palmitoylation of PKM2. Adv Sci (Weinh). 2024 Dec 12:e2412895. doi: 10.1002/advs.202412895
[5] Mo Y, Han Y, Chen Y, Fu C, Li Q, Liu Z, Xiao M, Xu B. ZDHHC20 mediated S-palmitoylation of fatty acid synthase (FASN) promotes hepatocarcinogenesis. Mol Cancer. 2024 Dec 19;23(1):274. doi: 10.1186/s12943-024-02195-5
[6] S Mesquita F, Abrami L, Linder ME, Bamji SX, Dickinson BC, van der Goot FG. Mechanisms and functions of protein S-acylation. Nat Rev Mol Cell Biol. 2024 Jun;25(6):488-509. doi: 10.1038/s41580-024-00700-8
[7] Zhao C, Yu H, Fan X, Niu W, Fan J, Sun S, Gong M, Zhao B, Fang Z, Chen X. GSK3β palmitoylation mediated by ZDHHC4 promotes tumorigenicity of glioblastoma stem cells in temozolomide-resistant glioblastoma through the EZH2-STAT3 axis. Oncogenesis. 2022 May 23;11(1):28. doi: 10.1038/s41389-022-00402-w