

细胞代谢失调是导致恶性肿瘤发生和发展的原因之一。越来越多的证据表明,肿瘤代谢重编程是由内在变异和肿瘤微环境共同协调的。然而,在代谢重编程过程中肿瘤细胞与非肿瘤微环境成分之间的相互作用尚未得到充分的研究。胶质母细胞瘤(GBM)是成人中枢神经系统中最常见的原发性恶性肿瘤,具有高度侵袭性。尽管有积极治疗,GBM的复发率和致死率仍然很高。
2024年10月中国医科大学附属盛京医院吴安华教授团队在”Hexosaminidase B-driven cancer cell-macrophage co-dependency promotes glycolysis addiction and tumorigenesis in glioblastoma”文章。研究采用蛋白互作组分析、CO-IP、CHIP和RNA-seq等技术, GBM中己糖胺酶B(HEXB)驱动肿瘤细胞与巨噬细胞共依赖,促进糖酵解依赖性肿瘤生长,为治疗提供了潜在靶点。拜谱生物为该研究提供了蛋白互作组分析技术服务。

英文标题:Hexosaminidase B-driven cancer cell-macrophage co-dependency promotes glycolysis addiction and tumorigenesis in glioblastoma
中文标题:己糖胺酶B驱动的癌细胞-巨噬细胞共依赖性促进糖酵解依赖性和胶质母细胞瘤的肿瘤发生
期刊:Nature communications
2024年影响因子:14.7
发表时间:2024年10月
客户单位:中国医科大学附属盛京医院
研究材料:胶质母细胞瘤
拜谱提供技术:蛋白互作组分析
研究思路:
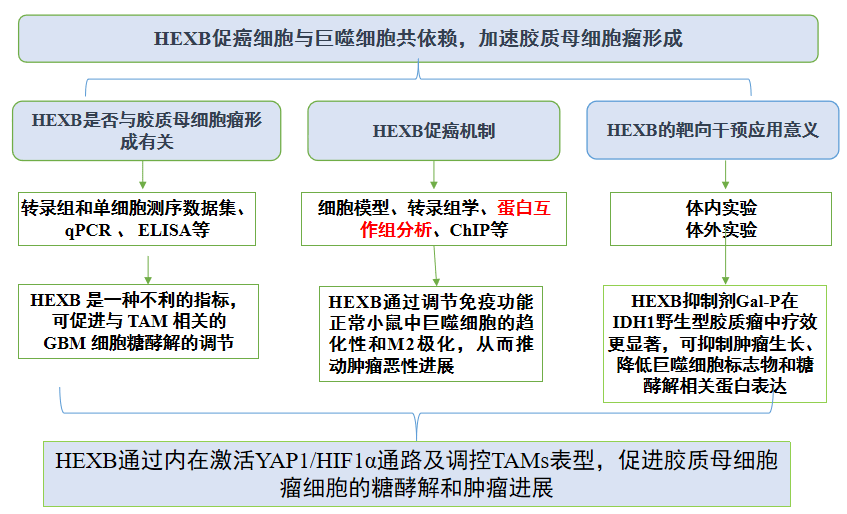
一、研究结果
01.HEXB调节与TAMs相关的GBM细胞糖酵解过程
通过RNA-seq数据集分析,筛选出了3个差异表达基因(SIPA1L1、GUSB和HEXB),并通过预后分析发现HEXB与GBM和胶质瘤患者的预后呈负相关(图1 a-c)。单细胞RNA分析显示,HEXB在GBM细胞和肿瘤相关巨噬细胞(TAMs)中均有高表达,尤其在M2型TAMs中。HEXB的表达与IDH1突变型胶质瘤中2-羟基戊二酸(2-HG)积累密切相关,且HEXB主要以同源二聚体(HEXB)形式在GBM中发挥作用(图1 e)。进一步的qPCR和ELISA分析显示,HEXB在GBM细胞和巨噬细胞中的mRNA和分泌水平升高(图1 g)。综合来看,HEXB可能通过促进GBM细胞的糖酵解,与TAMs相互作用,作为GBM预后的不良标志物。
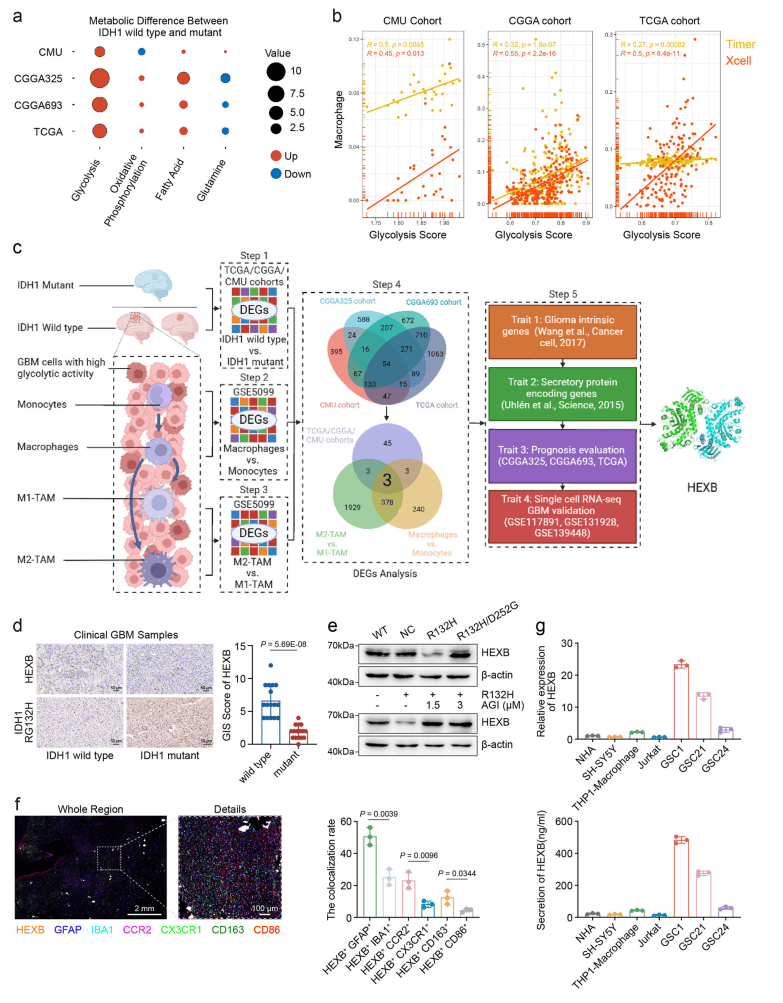 图2 HEXB是IDH1野生型胶质瘤中的关键内在分泌蛋白编码基因,与癌细胞糖酵解活性和TAM操纵有关
图2 HEXB是IDH1野生型胶质瘤中的关键内在分泌蛋白编码基因,与癌细胞糖酵解活性和TAM操纵有关
(图源:Zhu, Chen et al.,Nat Commun. 2024)
02.HEXB是GBM中癌细胞糖酵解和致瘤性的必要条件
通过在三种原代GBM球细胞系中沉默HEXB,发现糖酵解过程中的葡萄糖消耗和乳酸产生显著减少,且HEXB的遗传缺失和药物抑制均能显著降低GBM细胞的糖酵解速率(图2 a-e)。相反,重组人HEXB的处理能恢复HEXB干扰后GBM细胞的糖酵解活性。HEXB沉默显著降低了GBM细胞的体外增殖和体内生长,而这种作用可能依赖于调节GBM细胞的葡萄糖代谢,而非诱导细胞凋亡。在体内实验中,沉默HEXB的GBM细胞移植小鼠表现出肿瘤形成延迟和生存期延长(图2 f、g)。综上,HEXB是GBM细胞糖酵解的关键调节因子,通过增强糖酵解活性参与调控GBM细胞增殖。
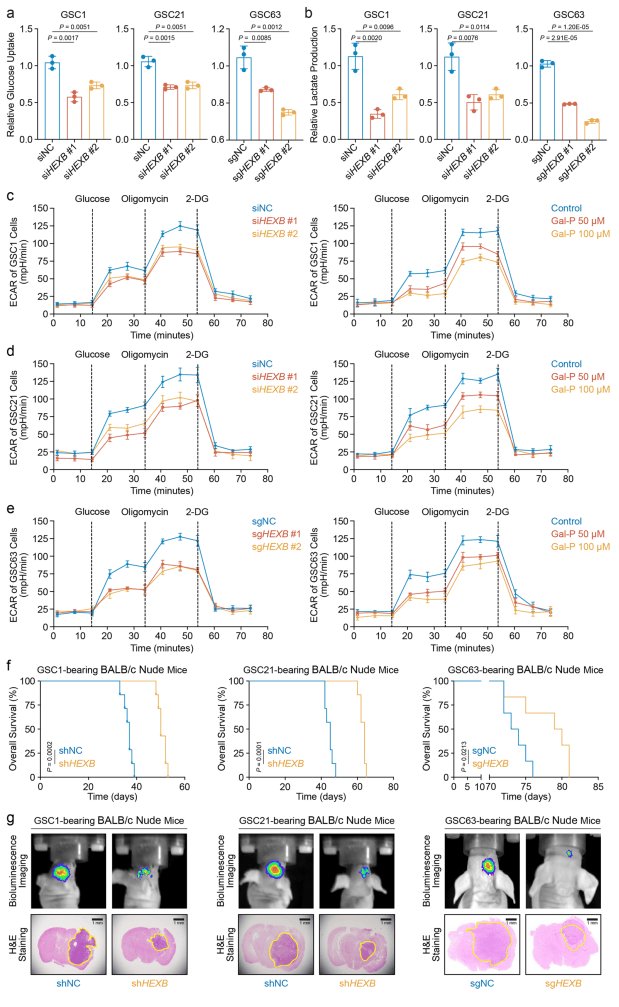 图2 HEXB是增强GBM细胞糖酵解活性的关键调节因子
图2 HEXB是增强GBM细胞糖酵解活性的关键调节因子
(图源:Zhu, Chen et al.,Nat Commun. 2024)
03.HEXB通过激活YAP1核转位促进糖酵解
转录组分析了HEXB沉默的GSC1细胞,并对与HEXB沉默下调基因相关的通路进行富集分析,发现HEXB沉默导致葡萄糖反应、整合素信号通路和YAP1相关基因的下调(图3 a、b)。免疫组化分析显示HEXB与YAP1在GBM组织中呈正相关,HEXB沉默显著减少YAP1表达,而外源性HEXB促进YAP1核转位(图3 c)。抑制HEXB增强LATS1磷酸化,减少YAP1总量并升高p-YAP1,反之,重组HEXB降低LATS1和YAP1磷酸化,升高YAP1总量(图3 f、g)。YAP-5SA突变体能够逆转Gal-P引起的糖酵解和增殖抑制,而YAP1抑制剂verteporfin抑制了rhHEXB的作用(图3 h、i)。结果表明,YAP1是HEXB加速GBM细胞糖酵解和增殖的关键介导因子。
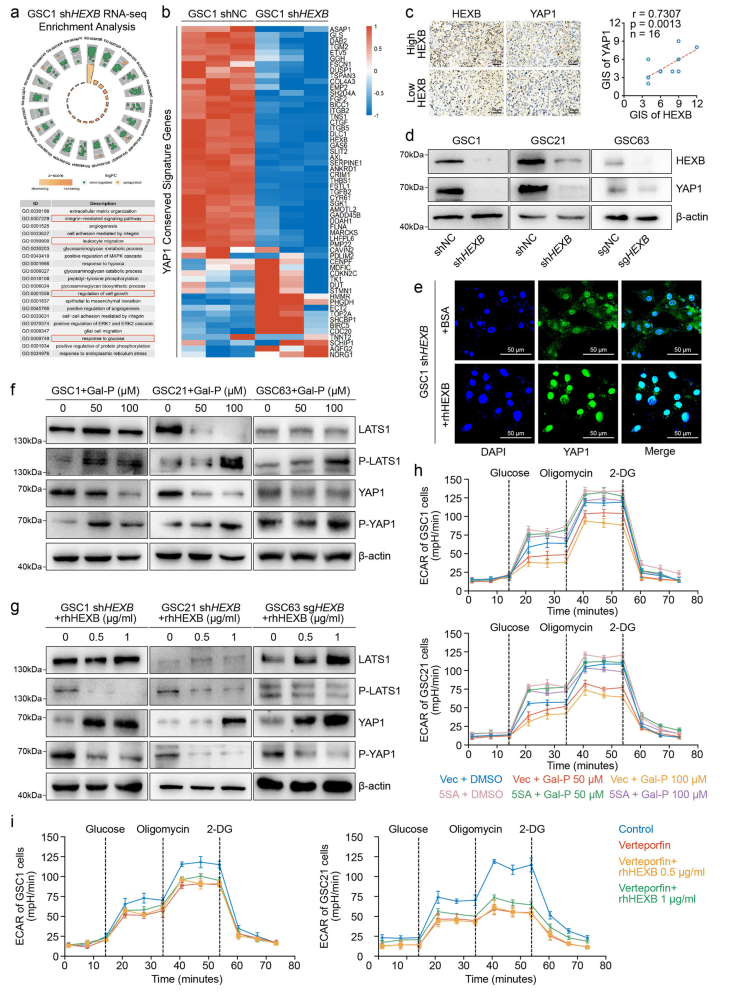 图3 HEXB通过促进YAP1核定位来促进糖酵解
图3 HEXB通过促进YAP1核定位来促进糖酵解
(图源:Zhu, Chen et al.,Nat Commun. 2024)
04.HEXB通过稳定ITGB1/ILK复合物促进GBM细胞中YAP1的激活
HEXB可促进GM2转化为GM3,但GM3已被证实对胶质瘤具有保护作用,抑制细胞增殖和侵袭。本研究发现,外源性GM3或GM2A敲低均未显著影响GBM细胞的增殖和乳酸产生,表明HEXB通过其酶活性促进GBM发展,而非依赖GM3。此外,HEXB抑制剂Gal-P显著削弱其糖酵解促进作用和下游信号激活(图2 c-e)。通过蛋白互作组分析发现HEXB可与膜受体ITGB1和ILK结合,形成跨膜蛋白复合物,进一步促进YAP1核转位(图4 a)。GST pull-down和截短突变实验表明(图4 b-f),HEXB的酶活性中心(asp196)位于81-200aa片段,该区域是HEXB与ITGB1结合的关键位点,asp196突变显著削弱HEXB与ITGB1的结合能力,证明HEXB酶结构域在其与ITGB1的结合中至关重要。
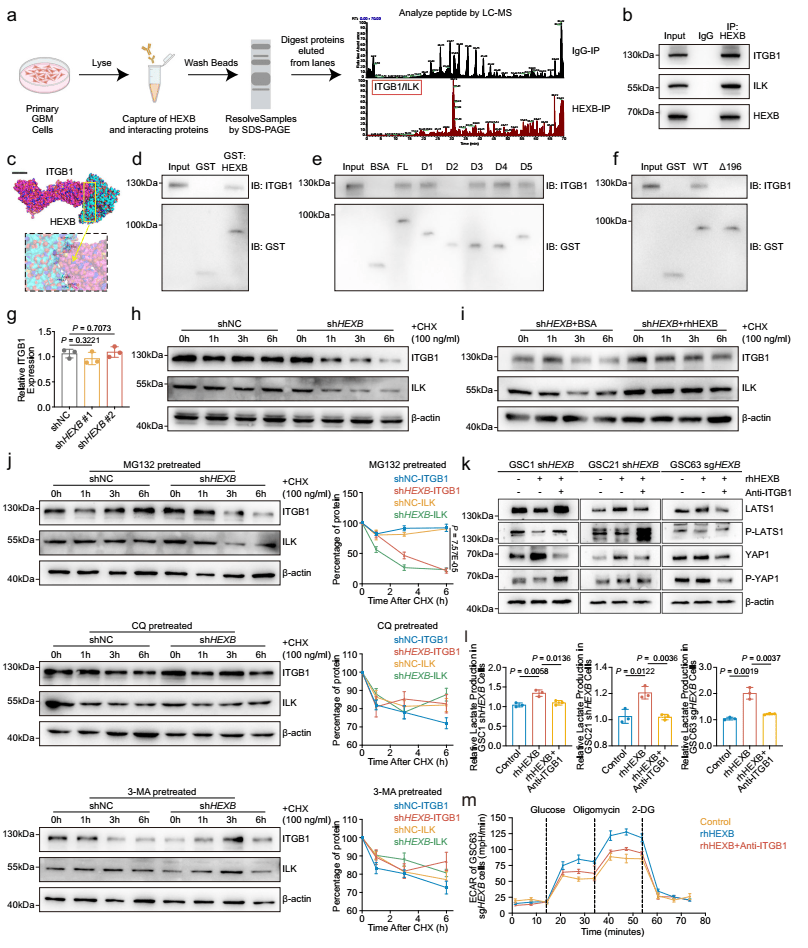 图4 HEXB通过稳定GBM细胞中的ITGB1/ILK复合物来促进YAP1活化
图4 HEXB通过稳定GBM细胞中的ITGB1/ILK复合物来促进YAP1活化
(图源:Zhu, Chen et al.,Nat Commun. 2024)
05.YAP1/HIF1α轴转录调控HEXB形成正反馈回路
外源性HEXB蛋白上调HIF1α转录活性,敲低HEXB显著减少HIF1α稳定性和其下游基因(PKM2、HK2)表达(图5 a-d)。ChIP实验显示HIF1α可直接结合HEXB启动子区域(215–236bp)(图5 l)。研究发现,IDH1野生型GBM细胞中HIF1α信号通路活性和转录活性高于IDH1突变型。抑制HEXB表达可减少IDH1野生型GBM细胞中HIF1α的下游效应,补充HIF1α激活剂CoCl2可恢复上述效应(图5 i、j)。这些结果揭示了HEXB通过ITGB1/ILK/YAP1轴促进HIF1α稳定性,而HIF1α反过来激活HEXB转录,形成GBM细胞中的正反馈环路(图5 m)。
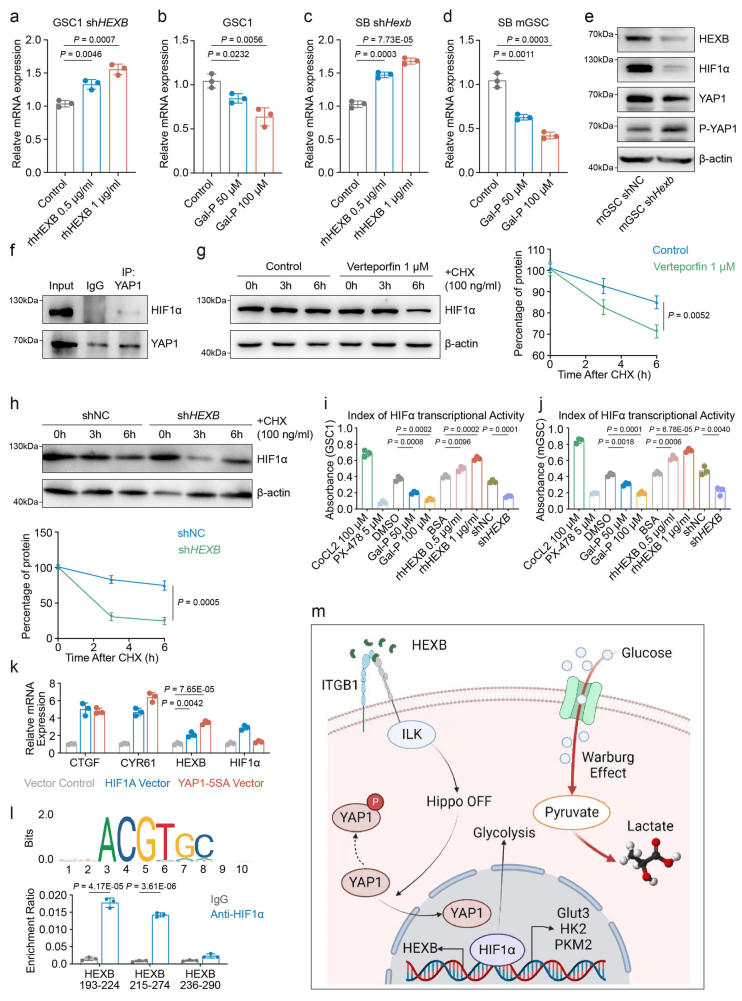 图5 YAP1/HIF1α有助于调节GBM细胞中HEXB转录
图5 YAP1/HIF1α有助于调节GBM细胞中HEXB转录
(图源:Zhu, Chen et al.,Nat Commun. 2024)
06.HEXB通过促进巨噬细胞趋化促进胶质母细胞瘤的恶性肿瘤
在TAMs模型中,与M2巨噬细胞共培养显著增强GBM细胞糖酵解活性。HEXB与M2标志物CD163共定位(图6 b),IDH1野生型GBM中HEXB与M1标志物CD86无显著相关。外源性HEXB增强THP1巨噬细胞趋化性和M2极化能力,且通过ITGB1受体介导趋化(图6 d、e)。敲低HEXB或Gal-P处理抑制M2极化和巨噬细胞浸润(图6 c)。动物实验显示,HEXB促进肿瘤增长,敲低Hexb或Gal-P处理显著延长小鼠生存时间并减少M2浸润(图6 g)。结果表明HEXB通过调节免疫功能正常小鼠中巨噬细胞的趋化性和M2极化,从而推动肿瘤恶性进展。
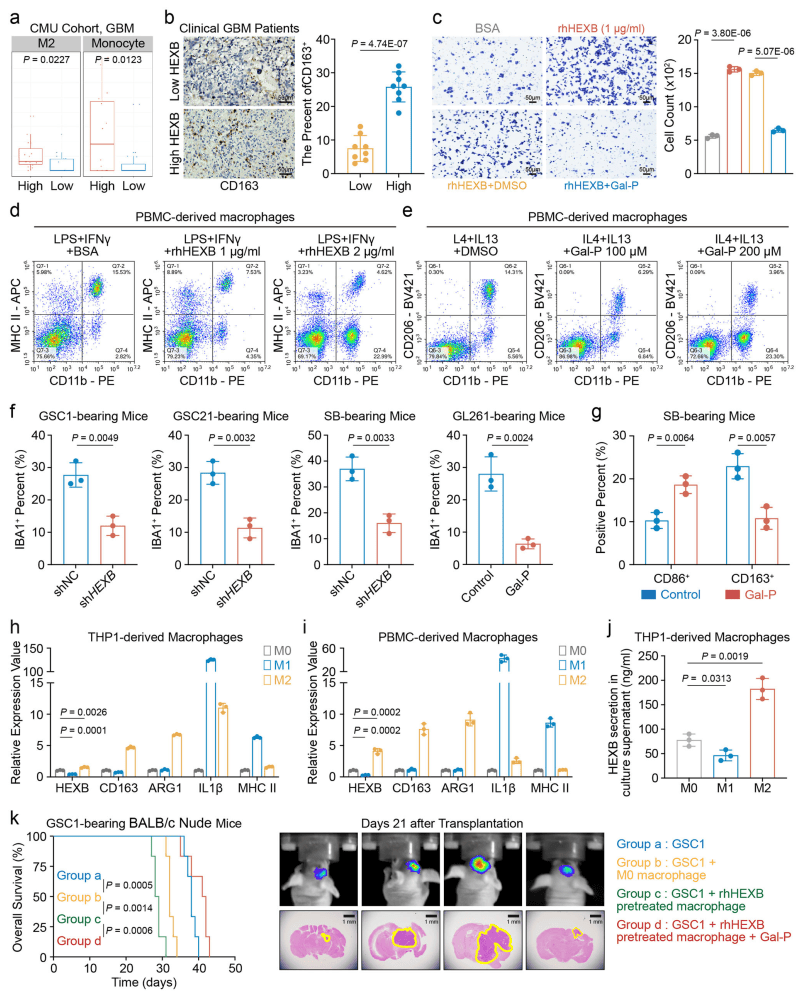 图6 HEXB有助于在GBM中建立恶性细胞和M2巨噬细胞之间的反馈
图6 HEXB有助于在GBM中建立恶性细胞和M2巨噬细胞之间的反馈
(图源:Zhu, Chen et al.,Nat Commun. 2024)
07.HEXB靶向干预对IDH1野生型患者更有效
体外和体内实验表明,HEXB抑制剂Gal-P在IDH1野生型胶质瘤中疗效更显著,可抑制肿瘤生长、降低巨噬细胞标志物和糖酵解相关蛋白表达(图7a-d)。此外,HEXB靶向治疗能显著增强抗PD-1或CTLA4免疫治疗效果(图7 g、h)。本研究阐明了HEXB在GBM糖代谢异常和免疫抑制微环境中的作用,并为IDH1野生型胶质瘤的联合治疗提供新靶点。
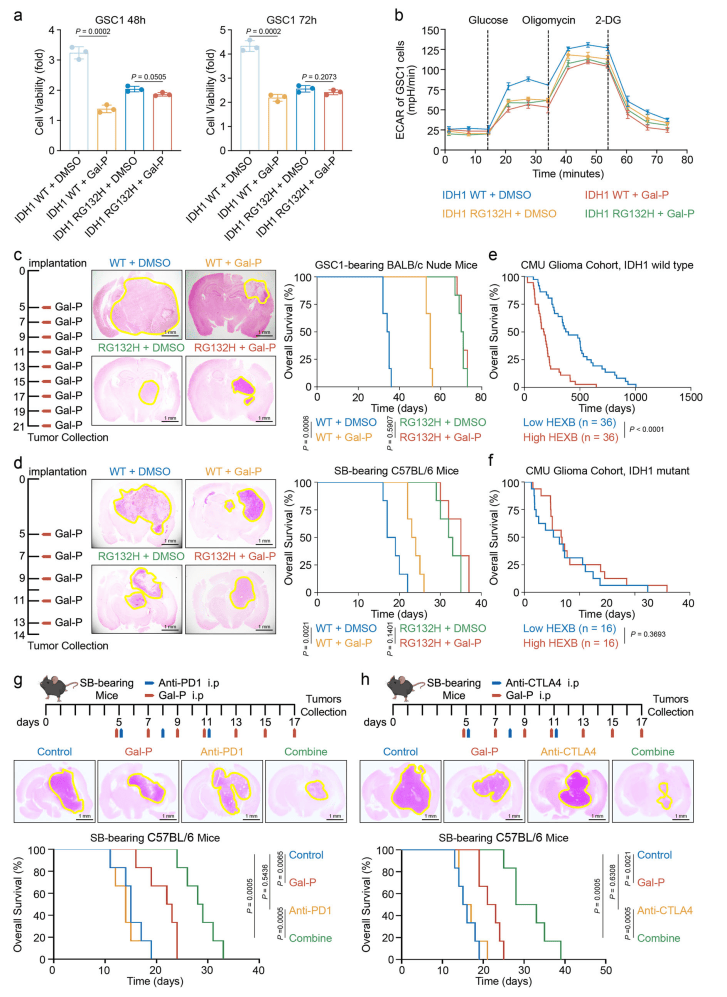 图7 IDH1突变抑制HEXB靶向干预胶质瘤的疗效
图7 IDH1突变抑制HEXB靶向干预胶质瘤的疗效
(图源:Zhu, Chen et al.,Nat Commun. 2024)
二.文章小结
HEXB是调控IDH1野生型胶质瘤中癌细胞糖酵解与TAMs相互作用的重要介质。HEXB通过内在激活YAP1/HIF1α通路及调控TAMs表型,促进胶质母细胞瘤细胞的糖酵解和肿瘤进展(图8)。在临床模型中,抑制HEXB表现出显著的治疗效果,为将来将HEXB靶向策略应用于GBM的临床研究奠定了基础。
 图8 HEXB在胶质瘤中的作用
图8 HEXB在胶质瘤中的作用
(图源:Zhu, Chen et al.,Nat Commun. 2024)
三、拜谱小结
研究采用蛋白互作组分析、CO-IP、CHIP和RNA-seq等技术,胶质母细胞瘤中HEXB驱动肿瘤细胞与巨噬细胞共依赖,促进糖酵解依赖性肿瘤生长,为治疗提供了潜在靶点。拜谱生物作为国内领先的多组学服务公司,可提供蛋白组、修饰组、代谢组、转录组等多组学产品服务,实现样品前处理、质谱检测、数据检索、生信分析一站式解决方案。欢迎咨询!
参考文献:
Zhu C, Chen X, Liu TQ, Cheng L, Cheng W, Cheng P, Wu AH. Hexosaminidase B-driven cancer cell-macrophage co-dependency promotes glycolysis addiction and tumorigenesis in glioblastoma. Nat Commun. 2024 Oct 1;15(1):8506. doi: 10.1038/s41467-024-52888-0. PMID: 39353936; PMCID: PMC11445535.