

组蛋白翻译后修饰(PTMs)是调控染色质结构和功能的关键生物化学过程。这些修饰通过在组蛋白上添加如甲基、乙酰等化学基团,精细调控染色质的包装状态,进而影响基因表达和细胞功能。随着表观遗传学的发展,我们对组蛋白修饰的认识不断深入,这些修饰不仅参与基因表达的调控,还与DNA复制、修复以及细胞分化等重要生物学过程密切相关。随着高通量组学技术和高灵敏度质谱技术的进步,新型的组蛋白修饰如琥珀酰化和乳酸化修饰等被陆续发现,这些发现极大地拓展了我们对组蛋白PTMs多样性和复杂性的认识。这些修饰不仅在细胞生理过程中扮演着重要角色,而且在疾病的发生发展中也具有潜在的影响。
接下来,我们来看一下Science近日发表的两篇研究论文,它们分别从不同角度揭示了组蛋白PTMs在基因表达调控中的作用。2024年12月12日Science杂志同时连发了两篇关于组蛋白翻译后修饰的研究。第一篇文章的题目是“Nutrient-driven histone code determines exhausted CD8+ T cell fates”,由美国加州拉霍亚市索尔克生物研究所NOMIS免疫生物学和微生物发病中心的Susan M. Kaech课题组发表,深入探讨了癌症和慢性病毒感染中经历代谢和表观遗传重塑过程,揭示了一种营养指导的组蛋白编码控制CD8+ T细胞分化,这对基于代谢和表观遗传学的T细胞治疗具有重要意义。

CD8+ T细胞在抗肿瘤和抗病毒免疫中起着关键作用,但其功能可因持续抗原刺激和炎症环境而耗竭。耗竭的CD8+ T细胞(TEX细胞)表现出增殖能力下降、细胞因子产生减少和杀伤功能受损等特点。本研究旨在揭示营养物质如何利用组蛋白密码来调控CD8+ T细胞的分化,特别是向耗竭状态的分化。
除了转录和表观遗传重编程,代谢重编程是T细胞分化的另一个标志。许多代谢中间体被用来修饰细胞的表观基因组,如乙酰辅酶A—组蛋白乙酰化的专性底物。在哺乳动物细胞中,负责乙酰辅酶A合成的两个主要酶是乙酰辅酶A合成酶2 (ACSS2)和ATP-柠檬酸裂解酶(ACLY),它们分别从乙酸和柠檬酸合成乙酰辅酶A。然而,目前尚不清楚是由这些酶合成的总乙酰辅酶A库,还是由特定营养物质产生的局部库,负责塑造肿瘤和慢性感染中CD8+ T细胞的独特表观遗传景观和分化状态。
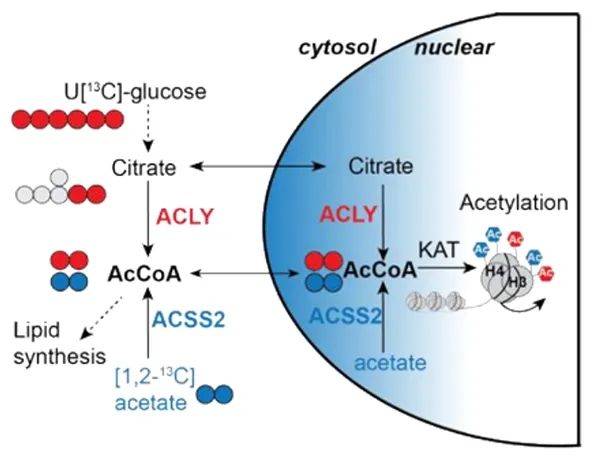 图1 ACSS2和ACLY在细胞之间调节乙酰辅酶A的产生和组蛋白乙酰化的差异
图1 ACSS2和ACLY在细胞之间调节乙酰辅酶A的产生和组蛋白乙酰化的差异
(图源:Ma, et al., Science, 2024)
本研究发现ACSS2和ACLY在功能性效应T细胞(TEFF)和耗竭T细胞(TEX)中存在不同的表达模式。ACSS2在功能失调的小鼠肿瘤浸润淋巴细胞(TILs)中相对于功能性脾CD8+ T细胞表达降低,而ACLY的表达在所有三种CD8+ T细胞状态中都相对稳定或略有增强。随着CD8+ T细胞从效应细胞分化为耗竭细胞,特别是从TEX prog向TEX term分化时,它们对ACSS2和ACLY的依赖发生变化。TEX term细胞更倾向于依赖ACLY和葡萄糖进行组蛋白乙酰化,而TEX prog细胞则更依赖ACSS2和醋酸盐。进一步研究发现ACSS2和ACLY分别与p300和KAT2A协调作用,以调节组蛋白乙酰化。ACSS2提供核定位的乙酰辅酶A给p300,促进TEX prog细胞发育;而ACLY提供的乙酰辅酶A则主要支持KAT2A的催化活性,促进TEX term细胞形成。
该研究揭示了营养物质如何通过调控组蛋白修饰来影响CD8+ T细胞的分化命运,特别是向耗竭状态的分化。这一发现为基于代谢和表观遗传的T细胞疗法提供了新的见解和潜在靶点。通过调节ACSS2和ACLY的活性或表达,可能改善CD8+ T细胞的功能和持久性,从而增强抗肿瘤和抗病毒免疫应答。
第二篇文章的题目是“Structural basis of H3K36 trimethylation by SETD2 duringchromatin transcription”,由哈佛医学院的Lucas Farnung教授领衔,揭示了组蛋白甲基转移酶 SETD2 在染色质转录过程中如何催化组蛋白 H3K36 的三甲基化 (H3K36me3)。

H3K36三甲基化(H3K36me3)是组蛋白H3赖氨酸36的三甲基化形式,在转录调控中扮演着至关重要的角色。它是活跃转录基因的重要标记,能够抑制基因内部的异常转录起始,从而确保转录过程的准确性和稳定性。此外,H3K36me3还为参与染色质维护、mRNA剪接、前mRNA处理以及DNA修复等多种生物过程的因子提供了招募平台。更重要的是,H3K36的突变已被发现与多种癌症的发生和发展密切相关,包括软骨母细胞瘤、结直肠癌和头颈鳞状细胞癌等。因此,H3K36三甲基化在维持基因表达的正常调控和防止疾病发生中具有不可或缺的作用。
文章聚焦于SETD2这一组蛋白甲基转移酶,通过生化实验和结构分析,详细阐述了SETD2如何通过其催化SET结构域催化H3K36的三甲基化过程,并发现这一过程与转录机器的相互作用紧密相连,从而揭示了SETD2在转录调控中的关键作用。研究进一步深入揭示了转录及转录延长因子如何促进H3K36me3的沉积,并阐明了SETD2如何在转录过程中特异性地结合并修饰核小体上的H3K36。此外,研究还强调了SETD2与转录延长因子SPT6的相互作用,以及这种相互作用对于H3K36me3沉积的重要性。总之,该研究为理解H3K36三甲基化在转录调控中的机制提供了重要见解。
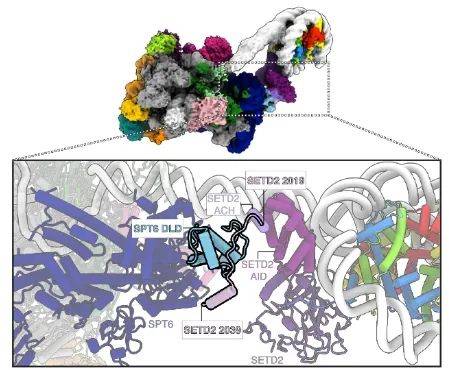 图2 SETD2 结构域
图2 SETD2 结构域
(图源:Markert, et al., Science, 2024)
拜谱小结
两篇研究文章均揭示了组蛋白翻译后修饰在细胞功能中的重要作用,强调了PTMs在基因表达调控和细胞命运决定中的关键角色,为未来的治疗策略提供了新的方向。
组蛋白修饰介导的基因表达调控作用于几乎所有的生物过程,因此,从横向研究方向来看,组蛋白修饰广泛参与发育和器官形成、肿瘤、神经疾病、衰老、遗传病等生理病理过程。从纵向研究机制来看,组蛋白修饰是受相关酶介导的动态可逆反应,相关酶的功能、组织及位点特异性、发掘药物靶标、药物治疗机制等研究其潜在应用方向。拜谱生物作为国内领先的多组学服务公司,可提供基因组、转录组、蛋白组、代谢组等多组学服务。作为国内唯一提供全局组蛋白修饰定量分析的公司,单针实现对组蛋白的多种修饰的全局检测,解析同一肽段的完整修饰信息及crosstalk,提供全面的流程服务与多元化的结果呈现,助力各位学者开展多个领域的研究,欢迎各位老师咨询!
参考文献:
[1] Markert JW, Soffers JH, Farnung L. Structural basis of H3K36 trimethylation by SETD2 during chromatin transcription. Science. 2024 Dec 12:eadn6319. doi: 10.1126/science.adn6319
[2] Ma S, Dahabieh MS, Mann TH, Zhao S, McDonald B, Song WS, Chung HK, Farsakoglu Y, Garcia-Rivera L, Hoffmann FA, Xu S, Du VY, Chen D, Furgiuele J, LaPorta M, Jacobs E, DeCamp LM, Oswald BM, Sheldon RD, Ellis AE, Liu L, He P, Wang Y, Jang C, Jones RG, Kaech SM. Nutrient-driven histone code determines exhausted CD8+ T cell fates. Science. 2024 Dec 12:eadj3020. doi: 10.1126/science.adj3020