

前言
在抗衰老领域,科研人员一直在寻找能够延缓细胞衰老、延长健康寿命的方法。随着科学的进步,我们对衰老的理解和干预手段也在不断深化。卡路里限制(CR),作为一种减少热量摄入而不引起营养不良的饮食干预方式,已被广泛证实能有效延长多种生物的寿命。CR通过一系列复杂的分子和细胞变化,维持线粒体的数量和质量,减少氧化损伤,抑制炎症,从而减缓与年龄相关的代谢紊乱和疾病的发展。然而,尽管CR的抗衰老效果已被广泛认可,但其背后的分子机制一直是个谜。
2024年12月18日厦门大学张宸崧和林圣彩院士团队在Nature期刊上背靠背发表了两篇文章。研究揭示了是石胆酸可模拟热量限制(CR)延缓衰老;热量限制模拟物石胆酸(LCA)激活AMPK的分子机制,发现TUB样蛋白3(TULP3)是LCA的直接受体,并鉴定出LCA通过激活TULP3–sirtuin–v-ATPase–AMPK通路,发挥延缓衰老的作用。
“Lithocholic acid binds TULP3 to activate sirtuins and AMPK to slow down ageing”文章,发现石胆酸(LCA)可能是解锁CR抗衰老效应的关键分子。研究人员利用质谱分析技术确认了LCA与TULP3蛋白的结合,并揭示了这一结合通过激活SIRT蛋白发挥作用。激活后的SIRT蛋白通过去乙酰化作用,有效抑制了溶酶体v-ATP酶的活性,从而触发了AMPK通路的激活,最终实现了延缓衰老进程的效果。这一发现不仅增进了我们对衰老机制的理解,还为未来的抗衰老干预提供了新的分子靶点。随着对LCA和AMPK通路的深入了解,我们有望开发出模拟CR效应的药物,为人类健康和长寿带来革命性的改变。

模式图
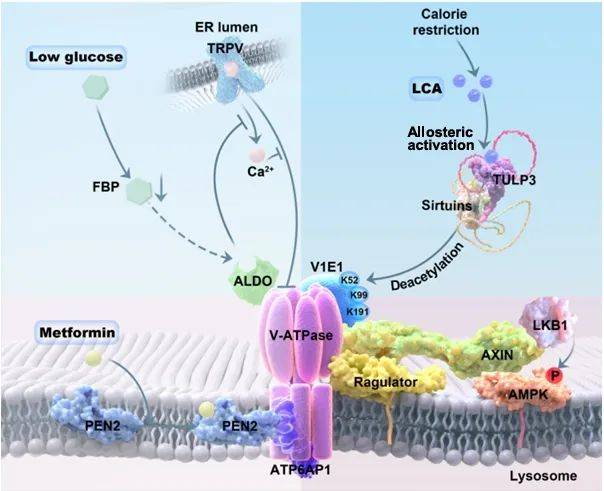 图1 模式图(图源:Qu, et al., Nature, 2024)
图1 模式图(图源:Qu, et al., Nature, 2024)
确定LCA 激活 AMPK 的机制
研究人员先前发现,LCA具备独立激活AMPK的能力,进而推测LCA可能借助溶酶体葡萄糖感应途径来实现AMPK的激活。为了揭示LCA激活AMPK的具体路径,研究团队运用了细胞和动物模型,结合基因敲除技术、免疫荧光染色等多种手段,揭示了LCA处理促使AXIN-LKB1复合物向溶酶体迁移,并抑制了v-ATPase的活性。在v-ATPase缺失、Axin1缺失以及Lamtor1缺失的细胞和动物模型中,LCA失去了激活AMPK的能力。据此,研究得出结论:LCA通过溶酶体途径激活AMPK,促使AXIN-LKB1复合物转移至溶酶体,从而激活AMPK,其中v-ATPase在LCA激活AMPK的过程中扮演了关键角色。这一发现为LCA的抗衰老机制提供了理论支撑。
为进一步探究LCA 导致 v-ATP 酶脱乙酰化以激活 AMPK的机制,研究人员运用IP-MS等技术手段,修饰水平分析显示,LCA处理后v-ATPase亚基V1E1的乙酰化水平降低。在构建的V1E1乙酰化位点突变细胞模型中,去乙酰化V1E1能够激活AMPK。利用特异性抗体检测到,LCA治疗后V1E1乙酰化水平降低。在CR模型中,V1E1乙酰化水平降低,提示CR诱导的AMPK激活可能与V1E1去乙酰化有关。研究结论表明,LCA通过诱导v-ATPase亚基V1E1去乙酰化,从而激活AMPK。
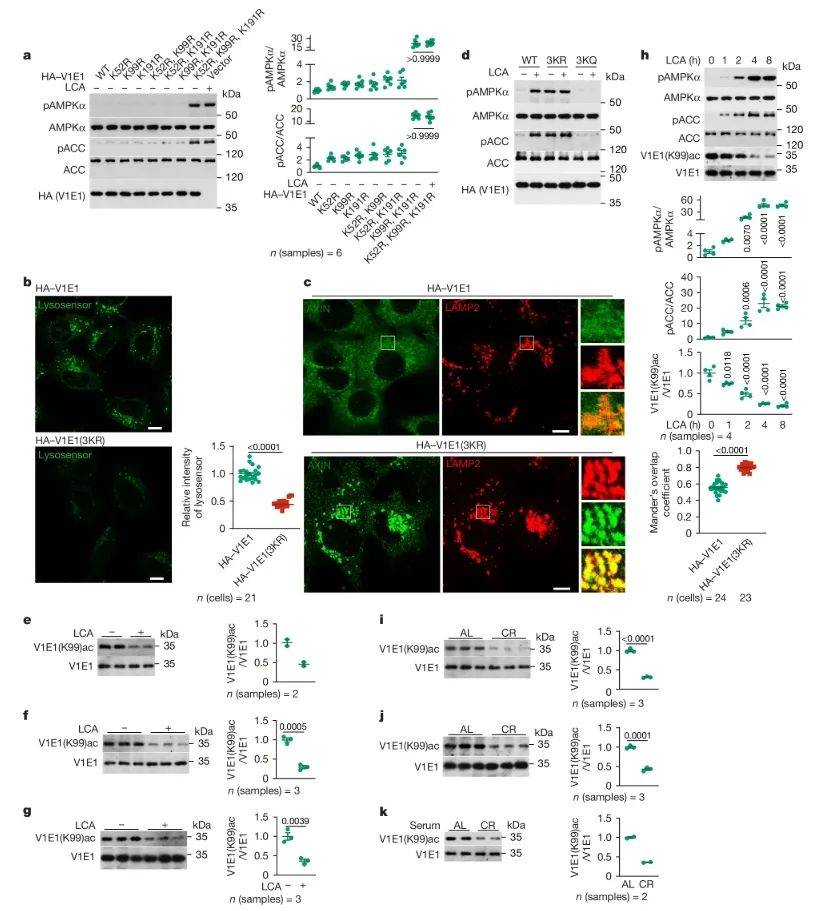 图2 LCA 导致 v-ATP 酶脱乙酰化以激活 AMPK(图源:Qu, et al., Nature, 2024)
图2 LCA 导致 v-ATP 酶脱乙酰化以激活 AMPK(图源:Qu, et al., Nature, 2024)
找出LCA 激活 SIRTs 的方式
在探讨LCA激活SIRTs的具体机制时,研究人员采用了SIRTs活性检测、构建SIRTs敲除模型和突变体等方法。研究结果表明,LCA处理能够激活SIRTs,并使细胞内NAD+水平升高。在SIRTs敲除模型中,LCA无法激活AMPK,而SIRTs突变体对LCA不敏感,但SIRTs不能与LCA结合,提示可能需要寻找新的结合伙伴。
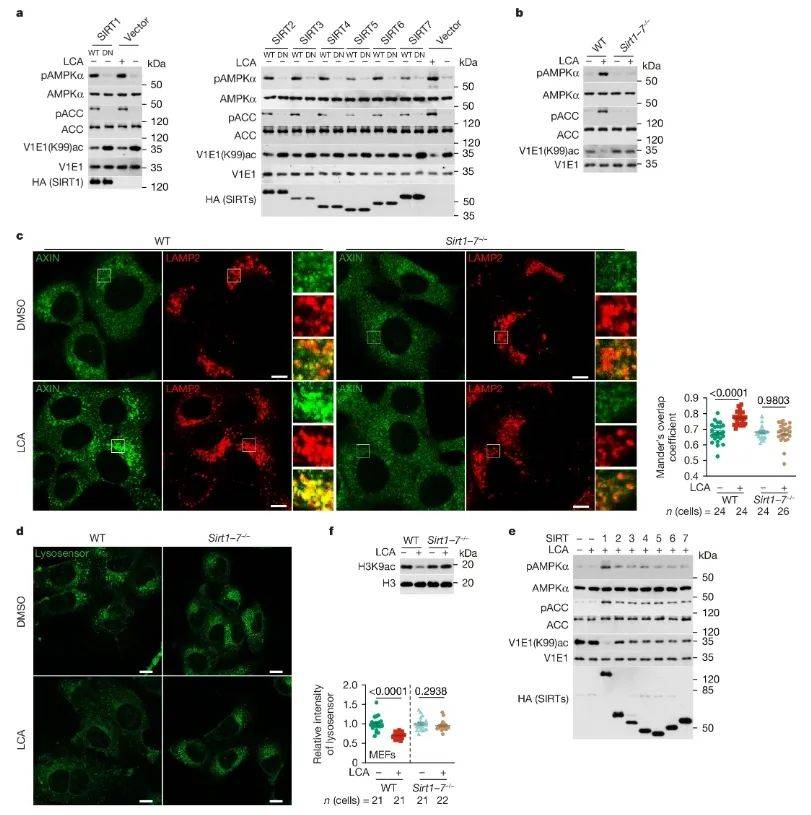 图3 去乙酰化酶是 v-ATP 酶脱乙酰所必需的(图源:Qu, et al., Nature, 2024)
图3 去乙酰化酶是 v-ATP 酶脱乙酰所必需的(图源:Qu, et al., Nature, 2024)
鉴定 LCA 的受体
为了确定LCA的受体,研究人员运用免疫共沉淀技术和质谱分析,筛选出与SIRT1相互作用的蛋白质,并通过基因敲除和功能验证来探究LCA受体在激活AMPK过程中的作用。研究发现,TULP3与SIRT1存在相互作用。在TULP3敲除模型中,LCA无法激活AMPK,且TULP3能与LCA结合并激活SIRT1。因此,研究指出TULP3是LCA的受体,通过与LCA结合激活SIRT1,进而激活AMPK。后续研究将聚焦于TULP3的结构和功能,及其在LCA激活AMPK中的具体作用机制,以及TULP3与其他代谢相关蛋白的相互作用及其在代谢调控中的作用,以期为LCA的作用机制提供更深入的解析。
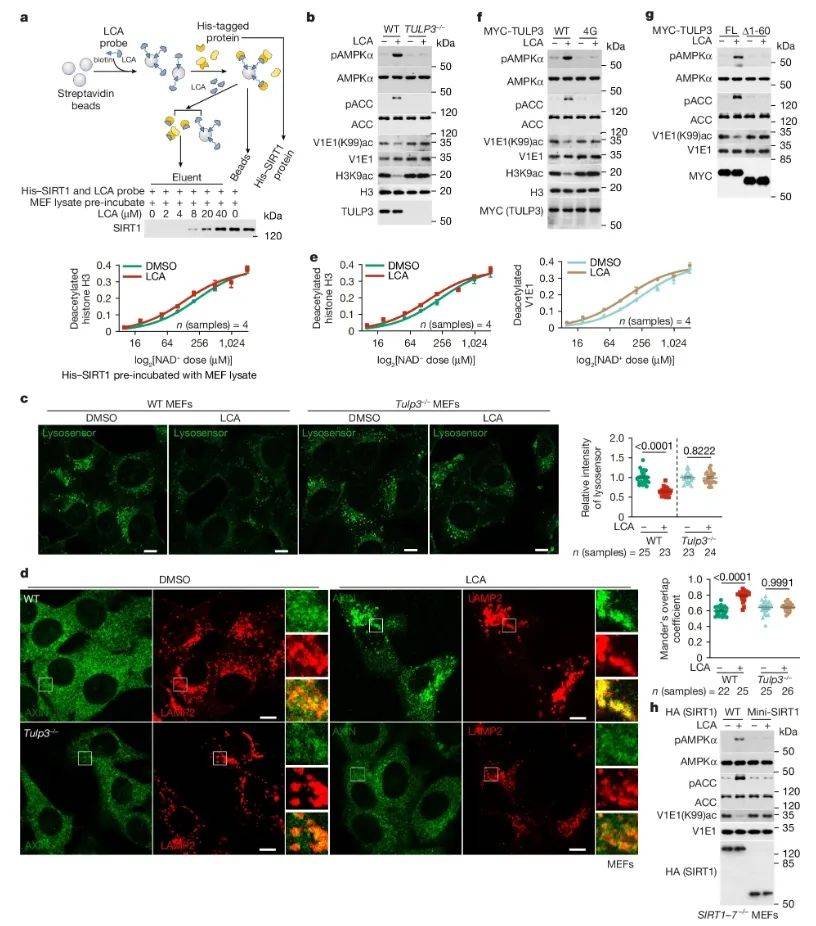 图4 TULP3 是 LCA 的结合蛋白,用于激活 sirtuins(图源:Qu, et al., Nature, 20
图4 TULP3 是 LCA 的结合蛋白,用于激活 sirtuins(图源:Qu, et al., Nature, 20
验证信号通路在 LCA 抗衰老作用中的重要性
最后,为了验证TULP3-sirtuin-v-ATPase-AMPK信号通路在LCA抗衰老作用中的重要性,研究人员构建了相关敲除和突变体动物模型,观察了LCA对动物寿命、运动能力、抗氧化能力、线粒体功能等方面的影响。结果显示,在相关模型中,LCA无法延长寿命和健康寿命。同时,LCA处理后,动物模型中的TULP3-sirtuin-v-ATPase-AMPK信号通路被激活。因此,研究认为该信号通路在LCA抗衰老作用中具有重要作用,LCA通过激活该信号通路发挥抗衰老作用。后续研究将深入探讨该信号通路的具体机制,及其与其他抗衰老信号通路的相互作用,并致力于开发基于该信号通路的抗衰老药物,为LCA的应用和抗衰老药物的开发提供新的方向。
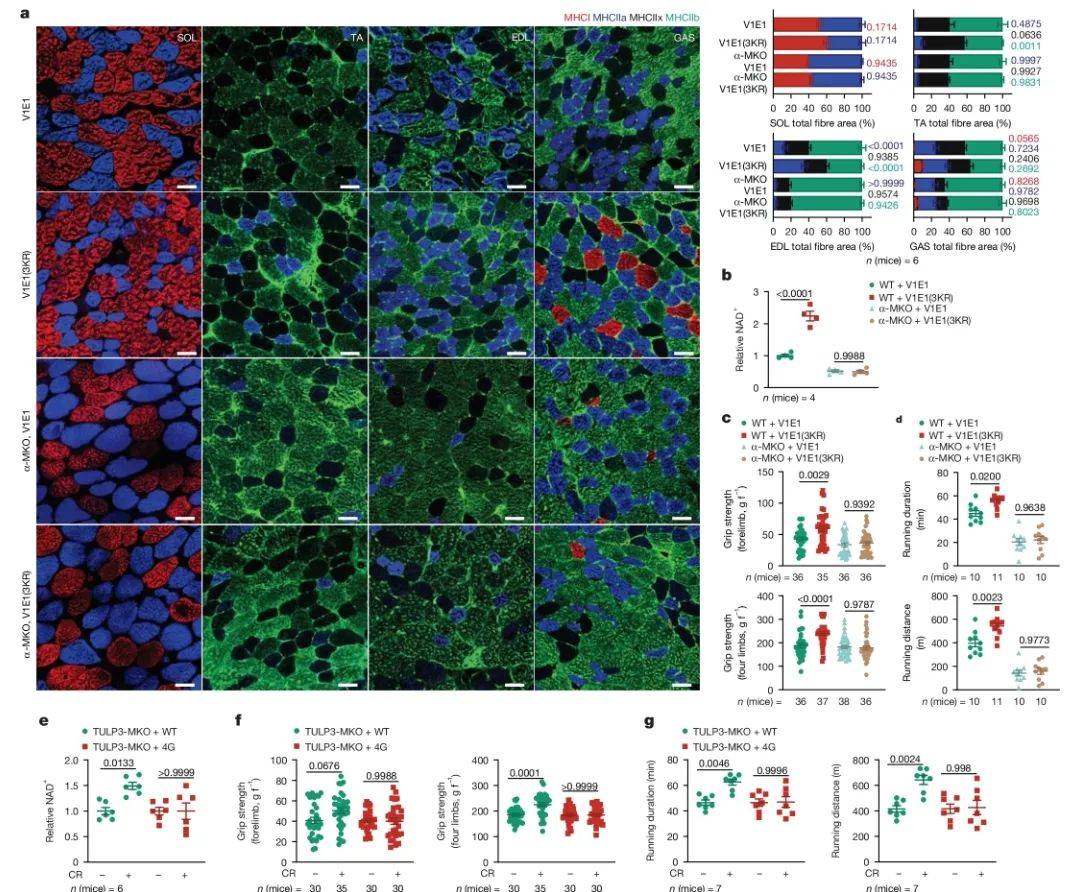 图5 LCA-TULP3-sirtuin-v-ATP 酶轴发挥恢复活力的作用
图5 LCA-TULP3-sirtuin-v-ATP 酶轴发挥恢复活力的作用
(图源:Qu, et al., Nature, 2024)
小结
这项研究不仅为我们提供了抗衰老的新视角,也为开发新的抗衰老疗法提供了可能。LCA的发现打开了一扇通往深入理解CR效应的大门,并且可能引领我们走向一个全新的抗衰老治疗时代。随着对LCA和AMPK通路的深入了解,我们有望开发出模拟CR效应的药物,这些药物能够在不改变饮食习惯的情况下,复制CR的积极影响,为人类健康和长寿带来革命性的改变。
拜谱小结
石胆酸的研究为我们提供了抗衰老的新视角,其中的一个研究重点是发掘能够调节AMPK活性的小分子药物靶点。AMPK作为细胞能量平衡的主要调节器,其活性的调节对于延缓衰老过程至关重要。通过深入研究LCA如何激活AMPK,我们可以识别出新的小分子化合物,这些化合物能够模拟LCA的效应,直接激活AMPK或其上游信号通路。这些小分子化合物有望成为抗衰老疗法的候选药物。
在药物开发的战略上,科研人员需要利用高通量筛选技术来筛选有效应的小分子化合物。利用代谢组学,发现疾病组或者处理组显著差异的小分子代谢物。蛋白质组学有助于揭示小分子化合物的作用机制;其中,定量蛋白质组学可以挖掘小分子背后的广泛靶点,而化学蛋白质组可以发现与小分子直接或者间接作用的靶蛋白。拜谱生物,作为国内领先的多组学公司,可提供完善成熟的蛋白组学、代谢组学、转录组学等多组学产品技术服务体系,助力高分文章的发表。此外,也开发了Lip-MS和化学点击等多种化学蛋白质组学技术,助力挖掘小分子化合物的靶点研究。欢迎大家致电咨询!
参考文献:
Qu Q, Chen Y, Wang Y, Wang W, Long S, Yang HY, Wu J, Li M, Tian X, Wei X, Liu YH, Xu S, Xiong J, Yang C, Wu Z, Huang X, Xie C, Wu Y, Xu Z, Zhang C, Zhang B, Feng JW, Chen J, Feng Y, Fang H, Lin L, Xie ZK, Sun B, Tian H, Yu Y, Piao HL, Xie XS, Deng X, Zhang CS, Lin SC. Lithocholic acid binds TULP3 to activate sirtuins and AMPK to slow down ageing. Nature. 2024 Dec 18. doi: 10.1038/s41586-024-08348-2