

脂化修饰是重要的翻译后修饰方式,脂蛋白通常对磷脂双分子层具有更高的亲和力,从而对蛋白质在细胞内的定位、转运、蛋白之间的相互作用和稳定性等产生重要影响。蛋白质脂化存在多种形式,常见脂肪酸都可通过脂肪酸酰化连接在蛋白质的半胱氨酸、甘氨酸或赖氨酸等残基上。
棕榈酰化修饰根据连接方式可以分为S-棕榈酰化、N-棕榈酰化和O-棕榈酰化,其中S-棕榈酰化是最常见的蛋白质脂化修饰,也被称为蛋白质棕榈酰化。可逆的棕榈酰化能够动态地调节底物蛋白的疏水性,从而在多种生理过程中发挥作用。随着蛋白质组学技术的发展,极大地推动了棕榈酰化修饰的研究进程,揭示了棕榈酰化修饰对癌症、糖尿病等人类疾病的重大影响。
2024年4-5月,Nature Cell Biology、Science Immunology、Nature杂志上三篇顶刊文章连发,先后报道了棕榈酰化修饰调控细胞焦亡过程的研究结果,突出了ROS在激活GSDMD过程中的重要性,并确定了ZDHHC家族酶在介导该修饰中的中心角色,揭示了棕榈酰化修饰在调节GSDMD功能中的新机制,为未来的药物开发和治疗策略提供了新的视角。下面是我们总结的三篇文献的主要研究成果,希望给您带来新的研究思路。
第一篇研究发表在2024年4月10日,由哈佛医学院的吴皓教授等人发表在Nature顶刊,论文题目为“ROS-dependent S-palmitoylation activates cleaved and intact gasdermin D”。该研究通过点击化学、质谱分析、电子显微镜等方法确认了S-棕榈酰化是GSDMD激活的关键调控步骤,并且这一过程受到ROS的调控,进一步揭示了GSDMD在炎症性疾病和细胞死亡中的新机制,为未来的药物开发和炎症性疾病的治疗提供了新的靶点。

英文题目:ROS-dependent S-palmitoylation activates cleaved and intact gasdermin D.
中文题目:依赖于ROS的棕榈酰化作用激活剪切和未剪切的气体门控蛋白D。
发表期刊:Nature
影响因子:50.5
发表时间:2024年5月
本研究发现GSDMD的Cys191位点发生S-棕榈酰化,而棕榈酰化对于孔洞的形成是必需的。S-棕榈酰化不会影响GSDMD的切割,但会随着线粒体产生的活性氧分子(ROS)而增强。在炎症小体刺激或活性氧分子激活剂治疗后,切割缺陷的GSDMD(D275A)也会发生棕榈酰化,并引起细胞焦亡。棕榈酰化的GSDMD会诱导脂质体泄漏并形成孔洞,这与冷冻电子显微镜显示的GSDMD-NT孔洞结构相似。ZDHHC5和ZDHHC9是主要的棕榈酰转移酶,负责介导GSDMD的棕榈酰化,它们的表达会受到炎症小体激活和活性氧分子的影响而上调。研究结果表明可逆的棕榈酰化是GSDMD-NT和完整GSDMD形成孔道的检查点,作为激活这个孔道形成家族的通用开关。
总之,这篇文章揭示了GSDMD的S-棕榈酰化修饰在细胞焦亡中的关键作用,发现ROS增强是激活GSDMD形成跨膜孔道的必需过程,为理解炎症反映中的细胞死亡提供了重要的分子机制,并为未来的药物开发提供了潜在的靶点。
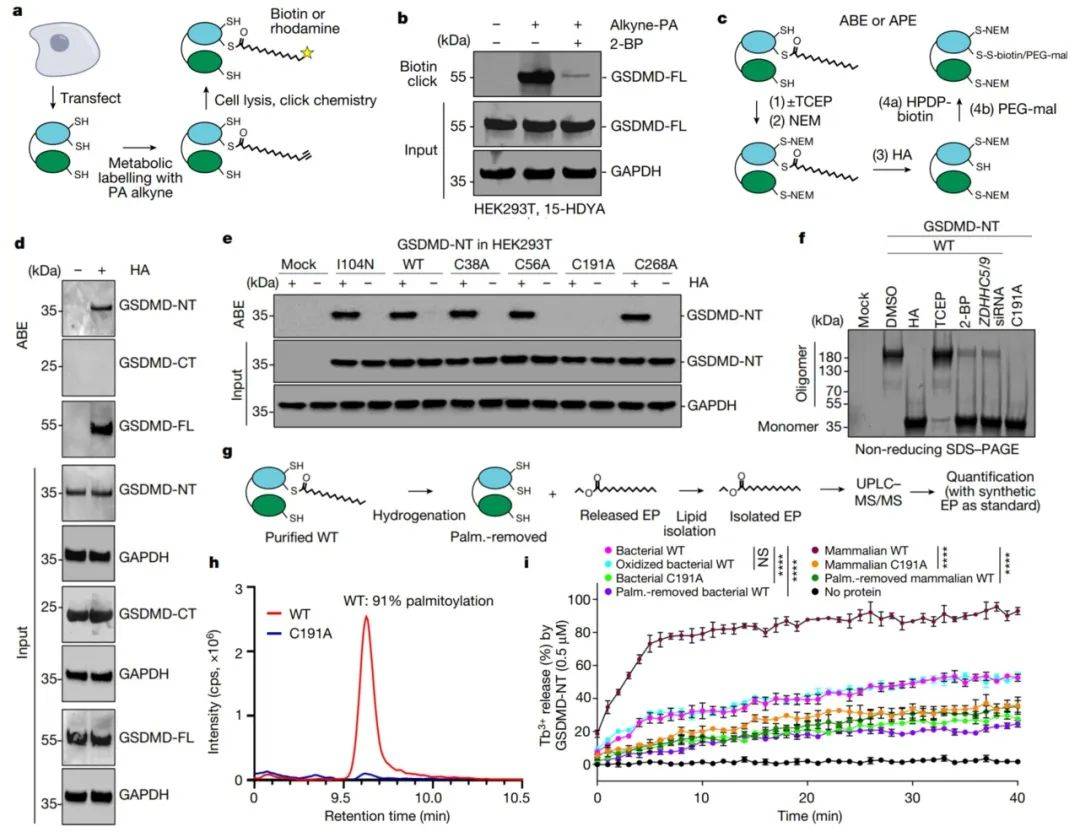 图1 GSDMD的棕榈酰化(图源:Du G et al., Nature, 2024)
图1 GSDMD的棕榈酰化(图源:Du G et al., Nature, 2024)
第二篇研究内容由哈佛医学院的罗洪波研究团队完成。研究成果以“The palmitoylation of gasdermin D directs its membrane translocation and pore formation during pyroptosis”为题发表在Science Immunology期刊上。该研究通过免疫共沉淀、质谱分析、点击化学、脂质结合实验等方法揭示GSDMD的棕榈酰化修饰和功能,目的是探索GSDMD的棕榈酰化对其在细胞膜上的转位和孔形成的影响,特别是在焦亡过程中。

英文题目:The palmitoylation of gasdermin D directs its membrane translocation and pore formation during pyroptosis.
中文题目:甘油二酯化后的气体门控蛋白D会引导其在细胞凋亡过程中穿过膜层并形成孔洞。
发表期刊:Science Immunology
影响因子:17.6
发表时间:2024年3月
本研究通过蛋白质组学方法,鉴定出脂肪酸合成酶(FASN)为GSDMD的结合伴侣。棕榈酰化酶ZDHHC5和ZDHHC9催化Cys/Cys(人/小鼠)位点的S-棕榈酰化,并且在活性氧(ROS)的促进下,直接介导GSDMD N端结构域(GSDMD-NT)的膜转位,但不影响全长GSDMD(GSDMD-FL)的膜转位。刺激物如脂多糖(LPS)可在炎症体激活前诱导GSDMD-FL的棕榈酰化,因此成为巨噬细胞激活的必要分子事件。结果表明抑制GSDMD棕榈酰化可抑制巨噬细胞焦亡和IL-1β的释放,减轻组织损伤,并增强感染小鼠的生存能力。因此,GSDMD-NT棕榈酰化是控制GSDMD膜定位和激活的关键调节机制,这可能为调节感染和炎症性疾病的免疫活动提供额外的靶点。
总之,本研究通过揭示GSDMD棕榈酰化在调控细胞焦亡中的核心作用,为开发针对炎症性疾病和感染性疾病的新疗法提供了重要的分子靶点和治疗策略。
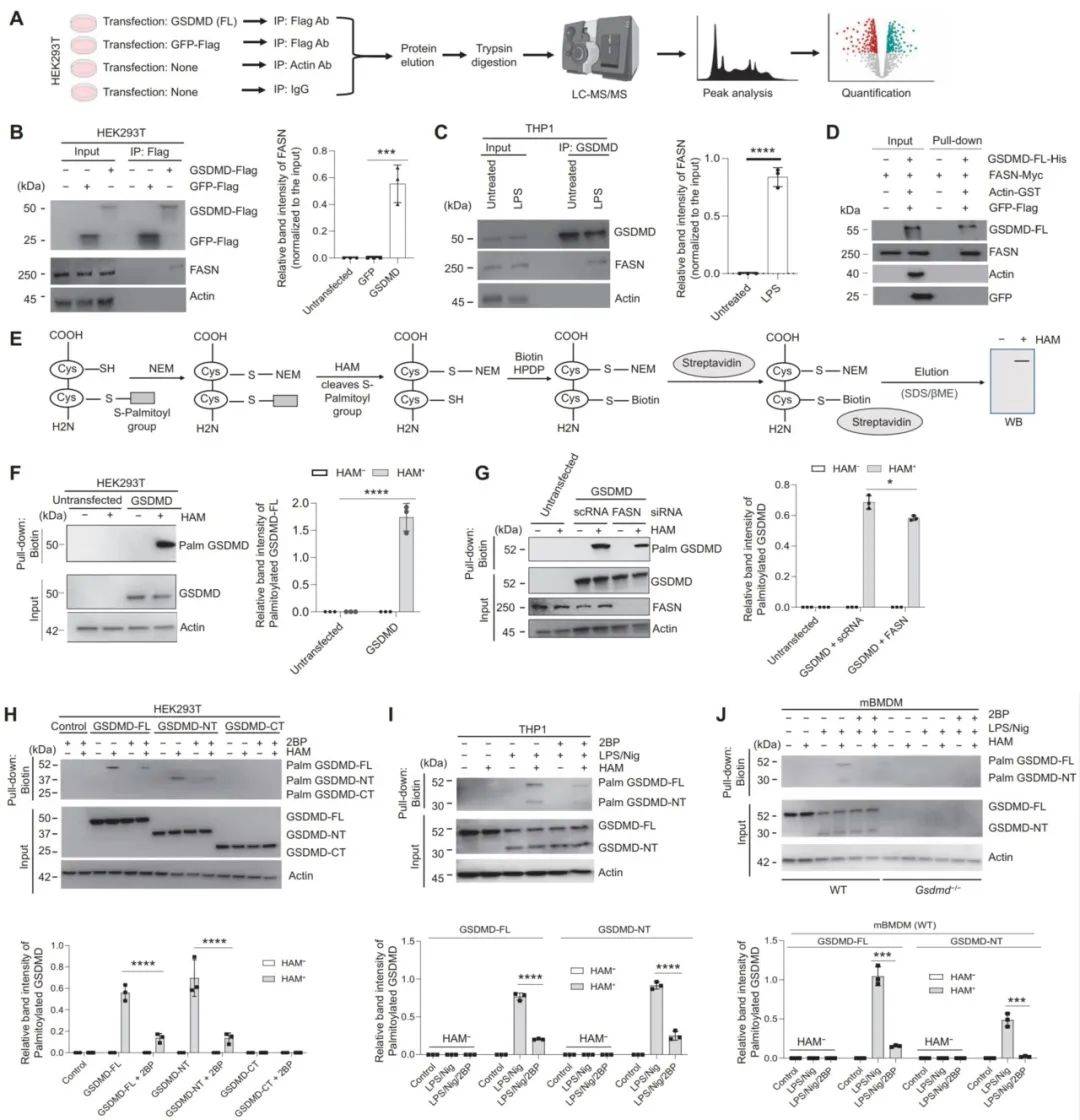 图2 GSDMD与FASN相互作用,GSDMD-FL和GSDMD-NT棕榈酰化
图2 GSDMD与FASN相互作用,GSDMD-FL和GSDMD-NT棕榈酰化
(图源:Balasubramanian A et al., Sci Immuno, 2024)
第三篇研究文章“A palmitoylation-depalmitoylation relay spatiotemporally controls GSDMD activation in pyroptosis.”由中国科学院上海有机化学研究所生物与化学交叉研究中心许代超研究团队发表于Nature Cell Biology期刊上。本文的主要研究目的是探究GSDMD在焦亡过程中的S-棕榈酰化修饰如何时空调控其激活,以及这一修饰如何影响细胞膜定位、寡聚化和孔隙形成,从而揭示其在宿主防御和炎症性疾病中的潜在应用。

英文题目:A palmitoylation-depalmitoylation relay spatiotemporally controls GSDMD activation in pyroptosis.
中文题目:棕榈酰化-去棕榈酰化循环在细胞焦亡过程中时空调控GSDMD的激活。
发表期刊:Nature Cell Biology
影响因子:17.3
发表时间:2024年3月
本研究发现GSDMD在细胞焦亡过程中可逆的发生棕榈酰化修饰,这一过程通过酰基转移酶DHHC7介导,并由去酰基酶APT2逆转。随后,GSDMD-NT的棕榈酰化促进其向细胞膜的转位,而APT2的去酰基化促进了GSDMD-NT的寡聚化和细胞膜上孔洞的形成,从而导致细胞焦亡和促炎细胞因子的释放。此外,研究发现对棕榈酰化或去棕榈酰化的干扰会抑制焦亡,增加小鼠在脂多糖诱导的致命性脓毒症中的存活率和细胞感染的敏感性。
总之,这些结果揭示了棕榈酰化-去酰基化接力在时空上控制GSDMD激活的新模式,为理解细胞焦亡的调控机制提供了重要见解,并可能为相关疾病的治疗提供新的靶点。
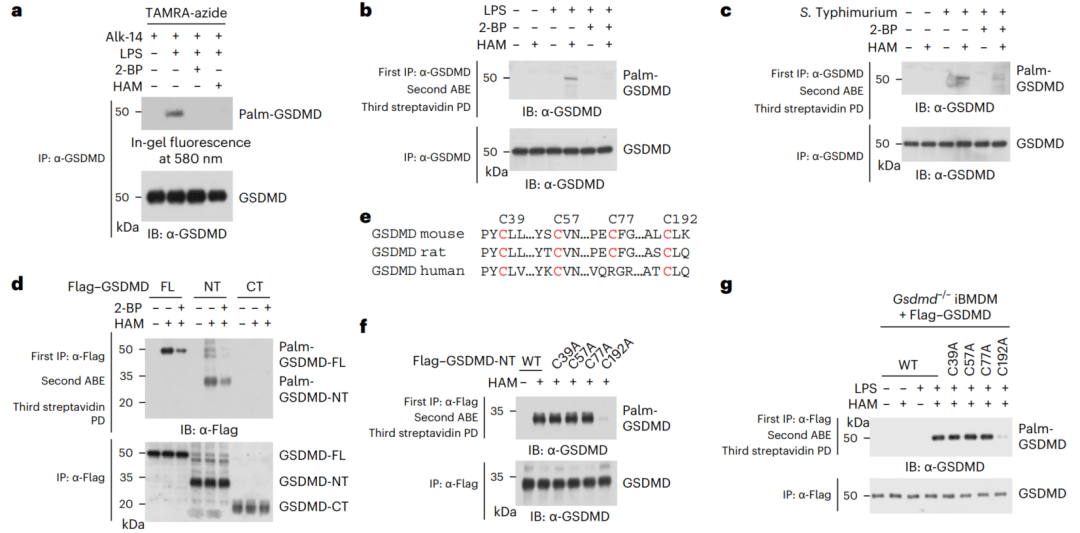 图3 GSDMD在响应LPS时被S-棕榈酰化
图3 GSDMD在响应LPS时被S-棕榈酰化
(图源:Zhang N et al., Nat Cell Biol, 2024)
小结
以上三篇文献均聚焦于GSDMD的S-棕榈酰化修饰在细胞焦亡中的作用。第一篇文献揭示了GSDMD的S-棕榈酰化时膜转位和孔形成的关键调控机制,这一过程由棕榈酰基转移酶(如ZDHHC5和ZDHHHC9)介导,且受ROS调控。第二篇文献进一步阐明了GSDMD在细胞焦亡中的时空调控机制,发现GSDMD的S-棕榈酰化和去棕榈酰化通过一个接力过程精确控制其激活。第三篇文献提出了即使未经炎症性半胱天冬酶切割,GSDMD的S-棕榈酰化也能激活并形成膜孔的新观点,强调了可逆棕榈酰化作为GSDMD家族激活的通用开关。总之,这些研究不仅深化了对GSDMD在炎症和细胞死亡中作用的理解,也为治疗相关疾病提供了新的潜在靶点。
拜谱小结
棕榈酰化是重要的脂质化修饰形式,一般发生在半胱氨酸残基上。棕榈酰化修饰最重要的功能是增强可通行蛋白与膜的亲和性,从而调控蛋白质的定位与功能。拜谱作为国内领先的多组学服务公司,可提供基因组、转录组、蛋白组、代谢组等多组学服务,其中棕榈酰化修饰蛋白质组是我司重磅特色产品,已经积累了丰富的项目经验,目前在高端Astral质谱仪的加持下,不同样品的棕榈酰化修饰位点平均检出量可达20000+,最高已突破40000+,助力客户解决科学难题。除此之外,拜谱生物还可提供半胱氨酸系列产品,包括亚硝基化、谷胱甘肽化、硫巯基化、次磺酸化、total氧化还原、游离巯基,欢迎大家咨询!
参考文献:
[1] Du G, Healy LB, David L, et al. ROS-dependent S-palmitoylation activates cleaved and intact gasdermin D. Nature. 2024;630(8016):437-446. doi: 10.1038/s41586-024-07373-5B1
[2] Balasubramanian A, Hsu AY, Ghimire L, et al. The palmitoylation of gasdermin D directs its membrane translocation and pore formation during pyroptosis. Sci Immunol. 2024;9(94):eadn1452. doi: 10.1126/sciimmunol.adn1452B1
[3] Zhang N, Zhang J, Yang Y, et al. A palmitoylation-depalmitoylation relay spatiotemporally controls GSDMD activation in pyroptosis. Nat Cell Biol. 2024;26(5):757-769. doi: 10.1038/s41556-024-01397-9