

在心血管疾病的复杂发病机制中,蛋白S-亚硝基化正逐渐展现出其独特的调控作用。S-亚硝基化是一种重要的蛋白质翻译后修饰方式,通过改变蛋白质的结构和功能,参与多种生理和病理过程。在心血管疾病中,蛋白S-亚硝基化的作用尤为突出。它不仅参与了血管平滑肌细胞的增殖、迁移和凋亡,还影响了心肌细胞的收缩和舒张功能。近年来,主动脉瘤和夹层作为心血管疾病中的严重并发症,其发病机制一直备受医学界关注。2024年2月15日,江苏省心脑血管药物重点实验室主任季勇教授在Circulation上在线发表了题为“S-Nitrosylation of Septin2 Exacerbates Aortic Aneurysm and Dissection by Coupling the TIAM1-RAC1 Axis in Macrophages”,文章采用生物素交换法结合液相色谱-串联质谱法鉴定并论证了Septin2的SNO(SNO-Septin2)在主动脉瘤和夹层发展中的作用,为心血管疾病的治疗带来新思路,具有广阔的应用前景。

英文标题:S-Nitrosylation of Septin2 Exacerbates Aortic Aneurysm and Dissection by Coupling the TIAM1-RAC1 Axis in Macrophages(Circulation,IF=37.80,2024)
中文标题:巨噬细胞中Septin2的S-亚硝基化通过偶联TIAM1-RAC1轴加重主动脉瘤和夹层
研究材料:人源及鼠源主动脉组织
组学技术:S-亚硝基化修饰组、转录组、蛋白IP-MS
一、主要研究结果
01.SNO-Septin2在主动脉瘤和夹层中升高
为了评估SNO在主动脉瘤和夹层中的作用,使用生物素交换程序和液相色谱串联质谱分析对接受主动脉夹层手术的患者和注射了AngII的 Apoe -/-小鼠的主动脉进行了无偏筛选。结果发现了7种S-亚硝基化的蛋白质,其中主动脉夹层患者的主动脉样本及外周血单核细胞中SNO-Septin2水平显著升高,在注射了AngII的 Apoe -/- 小鼠的主动脉中同样显著升高,并且通过质谱鉴定及点突变小鼠确定Cys11是Septin2的SNO位点(图1)。
 图1. 在主动脉瘤和夹层中,Septin2的SNO明显升高
图1. 在主动脉瘤和夹层中,Septin2的SNO明显升高
02.SNO-Septin2加重AngII诱导的主动脉瘤
为了研究SNO-Septin2在主动脉瘤中的作用,将雄性 Apoe -/-Sept2C111A小鼠和雄性 Apoe -/- 幼崽灌注Ang II 28天。 大体检查显示,Cys111突变显著减轻了Ang II诱导小鼠腹主动脉肾上区腔内扩张,并降低了主动脉瘤的发生率。 经腹超声成像和死后测量发现,Cys111突变导致腹主动脉直径减小,没有出现复杂的主动脉瘤表现,形态学观察显示Cys111突变显著减少了主动脉介质变性/夹层和腔内血栓。 免疫荧光显示Cys111突变小鼠总体基质金属肽酶(MMP)活性降低,巨噬细胞浸润减少。 以上结果表明抑制SNO-Septin2可以防止主动脉瘤的发展(图2)。
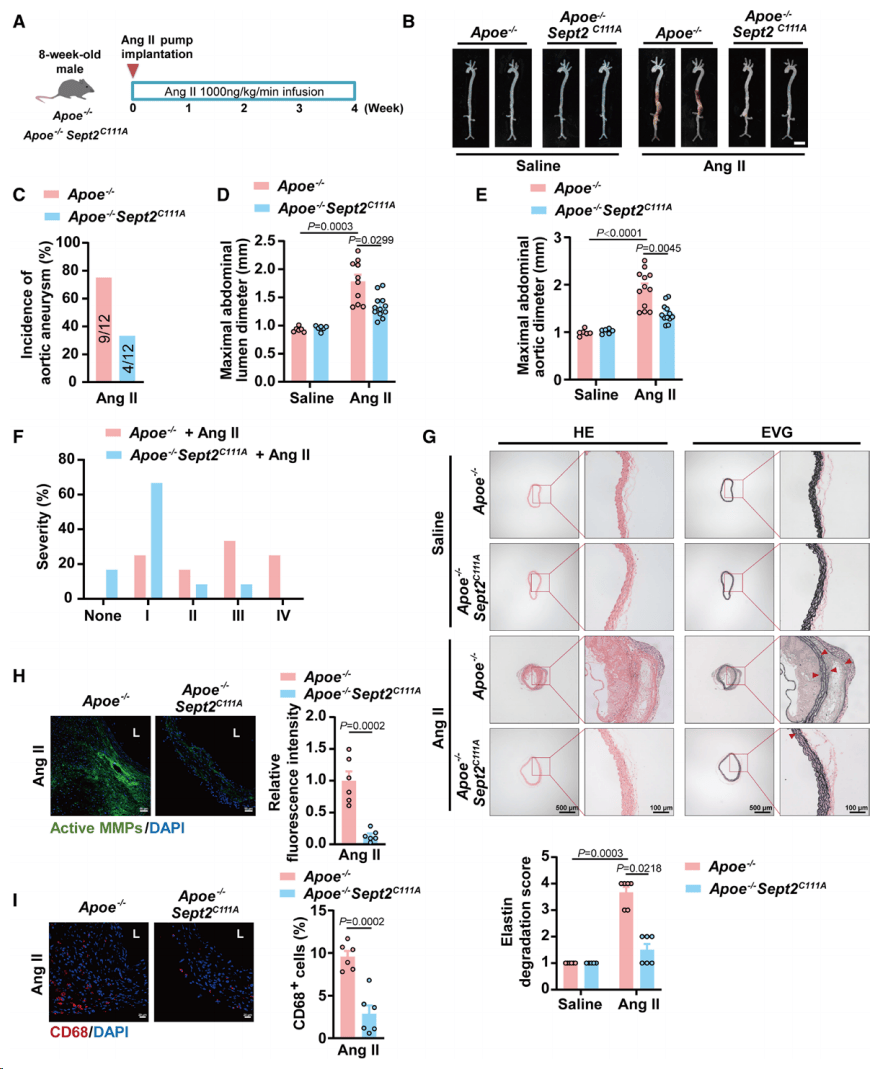 图2.Cys111突变的Septin2减轻主动脉瘤
图2.Cys111突变的Septin2减轻主动脉瘤
03.巨噬细胞Cys111突变抑制SNO-Septin2,并通过限制血管炎症和细胞外基质(ECM)降解缓解主动脉瘤
在巨噬细胞中,Septin2的Cys111突变显著降低了主动脉瘤的严重程度,限制了弹性蛋白的降解,降低了整体MMP活性和主动脉瘤病变中巨噬细胞的募集。为了探索SNO-Septin2在巨噬细胞中作用与主动脉瘤发育的分子机制,采集了两组经Ang II灌注28天的小鼠主动脉组织进行RNA测序分析,以确定SNO-Septin2在巨噬细胞中引起的转录组变化。基因本体富集分析显示,SNO-Septin2参与炎症反应和ECM降解。此外,观察到Cys111突变引起小鼠主动脉组织中多种炎症因子的减少,包括肿瘤坏死因子-α (TNF-α)、白细胞介素(IL)-6、IL-1β、MMP8和MMP9。为了验证这些结果,定量聚合酶链反应和ELISA表明, Apoe -/-小鼠巨噬细胞中的Cys111突变显著降低炎症因子,包括TNF-α、IL-6、IL-1β和MMP9,但不降低MMP8。免疫荧光检测证实巨噬细胞Cys111突变导致主动脉组织MMP9降低。总的来说,骨髓移植研究表明巨噬细胞中的Cys111突变在主动脉瘤的发展中起保护作用(图3)。
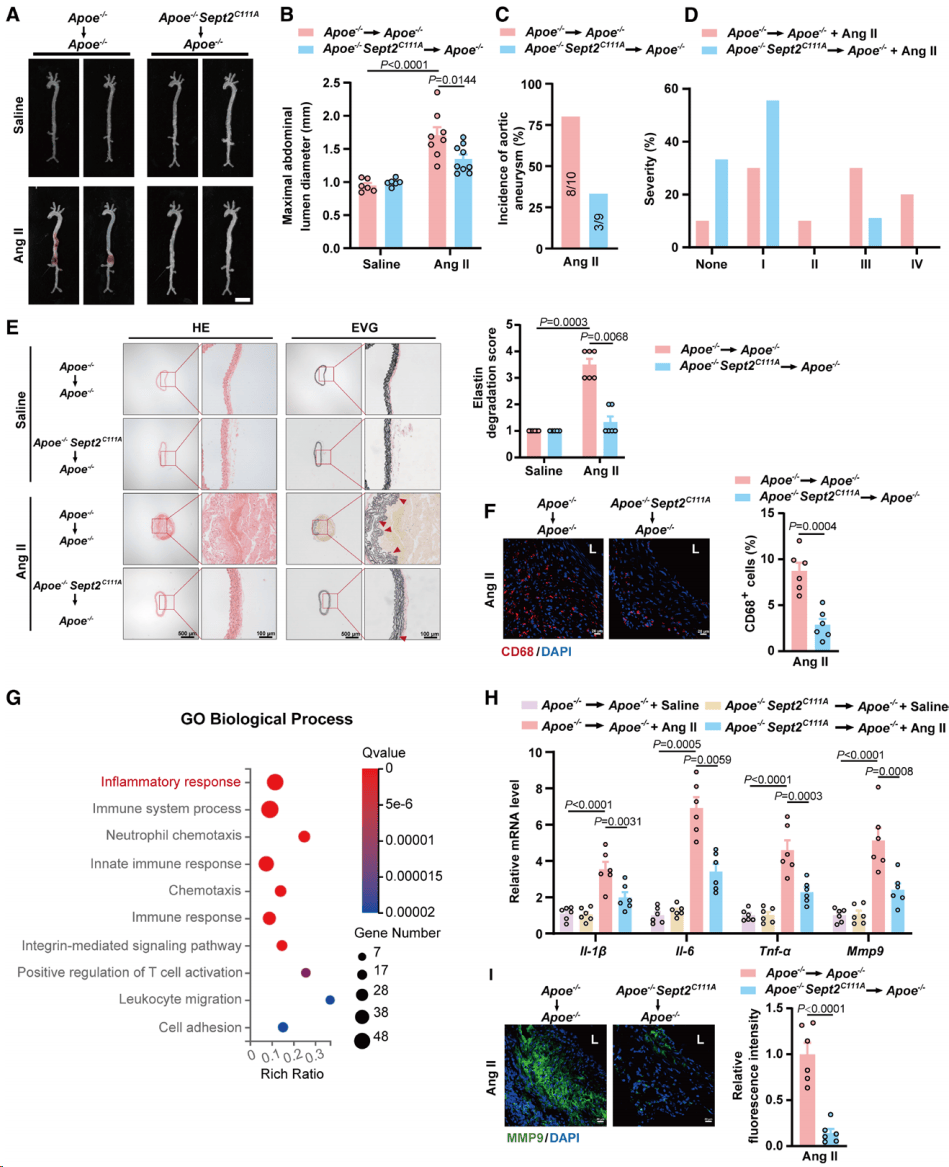 图3.巨噬细胞中Cys111突变抑制SNO-Septin2,通过限制血管炎症和细胞外基质降解来缓解主动脉瘤
图3.巨噬细胞中Cys111突变抑制SNO-Septin2,通过限制血管炎症和细胞外基质降解来缓解主动脉瘤
04.Septin2的Cys111突变通过RAC1/NF-κB通路减轻巨噬细胞炎症和MMP9表达
接下来,分离Sept2C111A 小鼠和Sept2WT 小鼠的骨髓来源巨噬细胞(BMDMs),用TNF-α处理并进行RNA测序分析。KEGG富集显示SNO-Septin2影响巨噬细胞NF-κB信号通路。为明确SNO-Septin2调控NF-κB信号通路的机制,采用共免疫沉淀-质谱法筛选Septin2的相互作用蛋白,对129个结合蛋白进行Reactome通路分析,结果显示SNO-Septin2参与Rho GTPase信号传导,其中表征最好的Rho GTPase包括RAC1、Cdc42及RhoA。Septin2的Cys111突变显著抑制了RAC1的激活,这表明SNO-Septin2介导的巨噬细胞活化依赖于RAC1的活化(图4)。
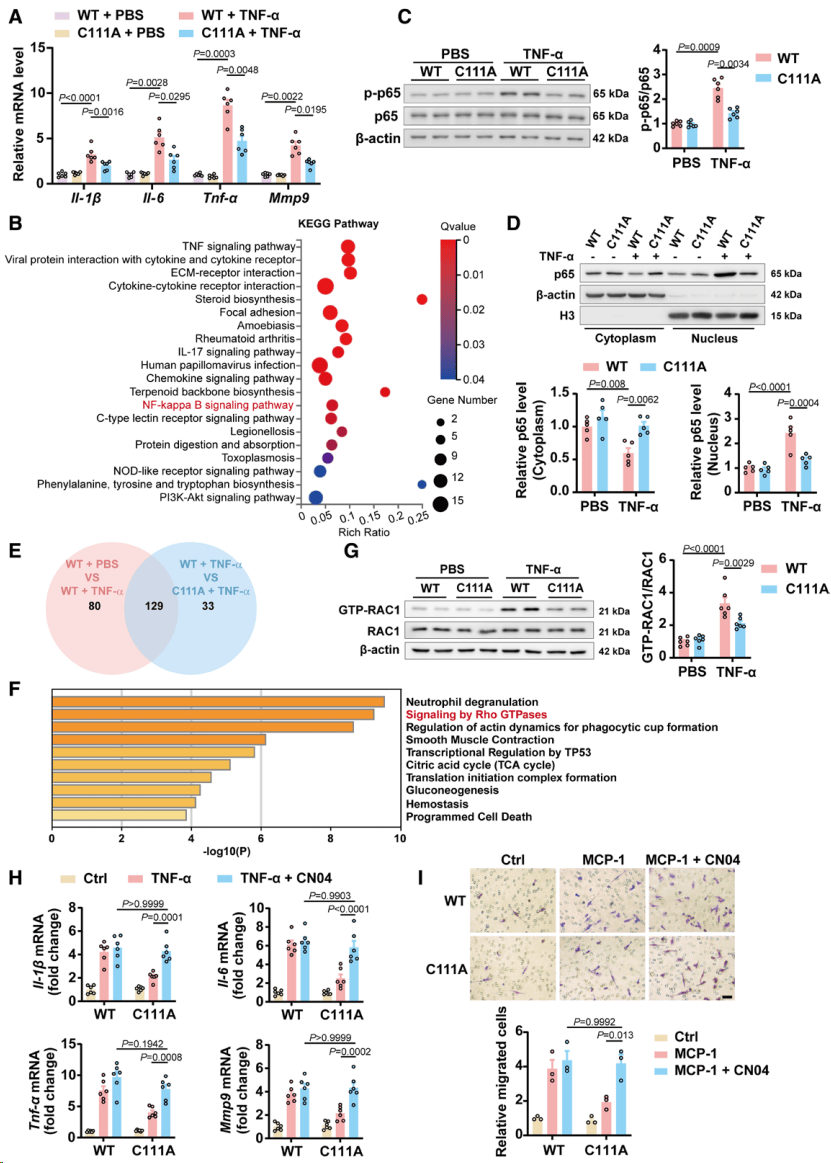 图4.亚硝基化Septin2通过RAC1/NF-κB途径诱导巨噬细胞炎症和迁移
图4.亚硝基化Septin2通过RAC1/NF-κB途径诱导巨噬细胞炎症和迁移
二、小 结
Septin2作为一种重要的细胞骨架蛋白,在巨噬细胞中发挥着关键作用。然而,当其受到S-亚硝基化修饰时,其结构和功能可能发生改变,进而影响细胞的正常生理功能。这种修饰可能导致巨噬细胞在主动脉壁中的行为异常,促进炎症反应和血管壁结构的破坏。与此同时,TIAM1-RAC1轴作为细胞信号转导的重要通路,与血管壁的稳定性和重塑密切相关。研究发现,当Septin2经历S-亚硝基化后,其与TIAM1-RAC1轴的偶联作用增强,可能进一步加剧血管壁的损伤和重塑过程。这一发现为我们理解主动脉瘤和夹层的发病机制提供了新的视角。
三、拜谱小结
巨噬细胞中的Septin2蛋白在经历S-亚硝基化修饰后,通过与TIAM1-RAC1轴的偶联,可能加剧主动脉瘤和夹层的发生风险。对于这一机制的深入研究,将有助于我们更好地预防和治疗这些心血管疾病。未来,通过深入研究巨噬细胞中Septin2的S-亚硝基化过程以及其与TIAM1-RAC1轴的相互作用,有望为开发新的治疗策略提供理论依据。拜谱生物作为一家国内领先的多组学公司,在半胱氨酸氧化还原修饰领域组积累了丰富的项目经验,成功助力Nature文章发表,可提供棕榈酰化、亚硝基化、谷胱甘肽化、次磺酸化、硫巯基化、Total 氧化还原、游离巯基蛋白质组学检测服务,欢迎致电咨询!
参考文献:
Zhang Y, Zhang H, Zhao S, Qi Z, He Y, Zhang X, Wu W, Yan K, Hu L, Sun S, Tang X, Zhou Q, Chen F, Gu A, Wang L, Zhang Z, Yu B, Wang D, Han Y, Xie L, Ji Y. S-Nitrosylation of Septin2 Exacerbates Aortic Aneurysm and Dissection by Coupling the TIAM1-RAC1 Axis in Macrophages. Circulation. 2024 Feb 15. doi: 10.1161/CIRCULATIONAHA.123.066404.