

COVID-19 会引起严重的全身炎症,并在致命病例中造成严重的器官损伤。尽管进行了广泛的研究,但对这些对人体影响的全系统、无针对性的研究很少,如何影响不同的身体组织尚不完全清楚。
2023年7月,德国马克斯·普朗克生物化学研究所在EMBO Molecular Medicine发表了题为“Quantitative multiorgan proteomics of fatal COVID-19 uncovers tissue-specific effects beyond inflammation”的文章。该研究对COVID-19死后患者队列和对照队列10个不同器官的352个FFPE样本进行了蛋白质组学分析,发现SARS-CoV-2感染的器官特异性在全身炎症反应中发挥的主要作用;肺部的蛋白质组变化与非 COVID-19 患者的弥漫性肺泡损伤 (DAD) 相似;肾脏、肝脏、淋巴和血管系统也出现了广泛的器官特异性变化;大脑中的继发性炎症效应与神经递质受体的重排和髓磷脂降解有关。这些蛋白质组学结果极大地促进了对COVID-19 病理机制的理解,并为器官特异性治疗干预策略提出了建议。
文章名称:Quantitative multiorgan proteomics of fatal COVID-19 uncovers tissue-specific effects beyond inflammation(EMBO Molecular Medicine,IF=11.1 ,2023)
研究材料:新冠患者FFPE样本
组学技术:DIA蛋白组、DIA磷酸化蛋白组
一、研究思路
 图1 研究思路(图源:Schweizer L, et al. EMBO Mol Med. 2023)
图1 研究思路(图源:Schweizer L, et al. EMBO Mol Med. 2023)
二、研究结果
01.FFPE蛋白质组学流程
本研究收集了19名COVID-19患者和85名对照患者共计353份FFPE样本,涉及肺、心脏、纵隔淋巴结、血管、大血管(主动脉)壁、脑(延髓、基底神经节)、肝脏、脾脏、肾脏和肾上腺10个不同器官。对于肺部 COVID-19标本,分为 COVID-19 急性期、组织期和纤维化期进行取样,除了非病理性对照组织外, 还额外对表型相似的非 COVID-19 肺部疾病(流感、非 COVID-19 弥漫性肺泡损伤、常见间质性肺炎、伴有肺进行性纤维化和纤维化机化性肺炎)取样作比较。进而,本研究对收集到的FFPE样本进行了蛋白质组学检测,在所有组织类型中总体鉴定了 7315 种蛋白质(图2)。
 图2. 项目设计与蛋白质组学流程(图片再编辑,源自:Schweizer L, et al. EMBO Mol Med.
图2. 项目设计与蛋白质组学流程(图片再编辑,源自:Schweizer L, et al. EMBO Mol Med.
02.全身炎症反应掩盖了组织特异性效应
本研究对患者组和对照组的差异蛋白进行了通路富集,这些通路在多个器官都被富集到,这些通路表明了该疾病的典型全身炎症作用(图 3A)。进一步对补体级联反应、干扰素信号通路中代表性蛋白进行定量分析,均发现在不同组织类型中表现失调(图3B、3C)。由于人体组织死后处理过程中无法排除血液成分,本研究重点关注血液蛋白质组的影响,发现红细胞 (RBC)标记物在COVID-19队列的一些样本中占主导地位(图 3D)。进一步分析发现,总体结果确实受到血液蛋白质组的影响,当去掉这些影响时,COVID-19 对宿主蛋白质组的影响更具器官特异性,大多数组织现在表现出独特且不同的差异调节蛋白质组(图 3E-H)。免疫系统的循环介导效应是 SARS-CoV-2 感染的全身效应的一部分,本研究揭示了循环介导效应在 COVID-19 组织蛋白质组数据中的主导作用。
 图3. 全身炎症反应掩盖了组织特异性效应(图源:Schweizer L, et al. EMBO Mol Med. 20
图3. 全身炎症反应掩盖了组织特异性效应(图源:Schweizer L, et al. EMBO Mol Med. 20
03.COVID-19 的肺部表现及相关肺部疾病的分类
为了将组织蛋白质组变化的非系统性影响与系统性影响区分开来,本研究对COVID -19系统都进行了去卷积。与健康肺组织(非病理对照,NPC)相比,COVID-19 肺组织中分别上调 384 个和下调533 个蛋白,针对病毒感染的免疫防御相关的蛋白显著增加,肺部具有功能或者结构意义的蛋白质显著下调(图 4A)。富集分析发现,参与防御病毒感染的蛋白质组装通路显著富集,与维持组织结构相关的过程显著减少(图 4B)。进一步将COVID-19的肺部表现与其他相关病理肺部疾病进行比较,发现了97个重要的蛋白质,聚类分析可以分为7簇(图4C-E)。相关性水平分析,发现COVID-19 的蛋白质组学特征与非 COVID19 DAD 的相关性最密切,反映了肺部 SARS-CoV-2 感染的主要组织病理学后果是显性弥漫性肺泡损伤(图4F)。
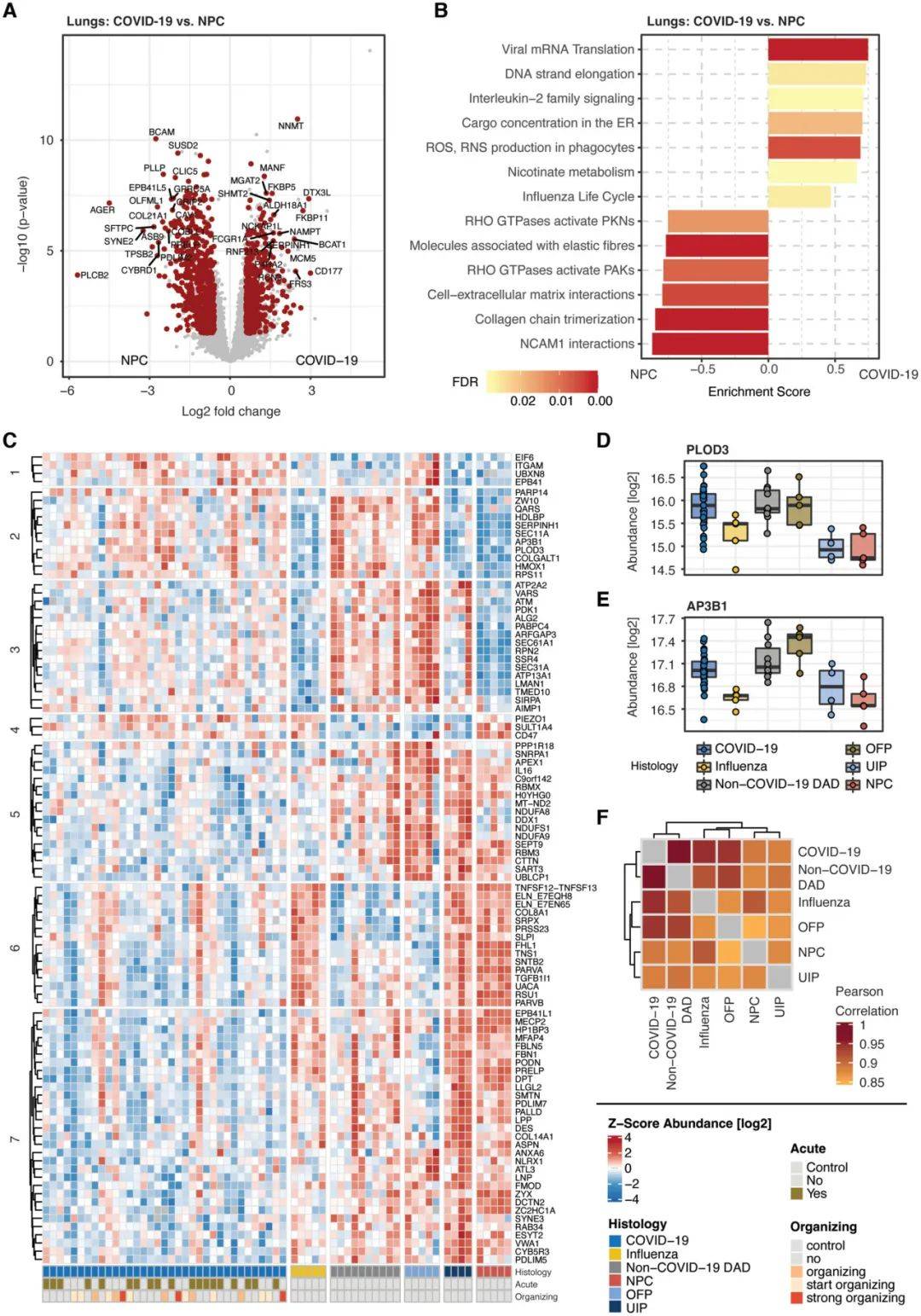 图4. 肺部表现及相关肺部疾病的分类(图源:Schweizer L, et al. EMBO Mol Med. 2023
图4. 肺部表现及相关肺部疾病的分类(图源:Schweizer L, et al. EMBO Mol Med. 2023
04.感染诱导的肺部磷酸化信号传导
为了研究 SARS-CoV-2 如何影响肺部细胞内信号级联,本研究对16个COVID-19和20个对照样本的FFPE组织样本进行了DIA磷酸化蛋白质组学分析,在 2681 个蛋白质上发现了 11531 个磷酸化位点。与 COVID-19 相比,NPC磷酸化蛋白质组表现出显著变化(图5A)。富集分析及聚类热图分析表明其显著差异与COVID-19蛋白组中Rho GTPase信号的大幅下调、mRNA加工和剪接有关(图5B-5D)。同时,mRNA处理、剪接机制和Rho GTPase信号的磷酸化增加与蛋白质水平的显著变化相关(图5E)。
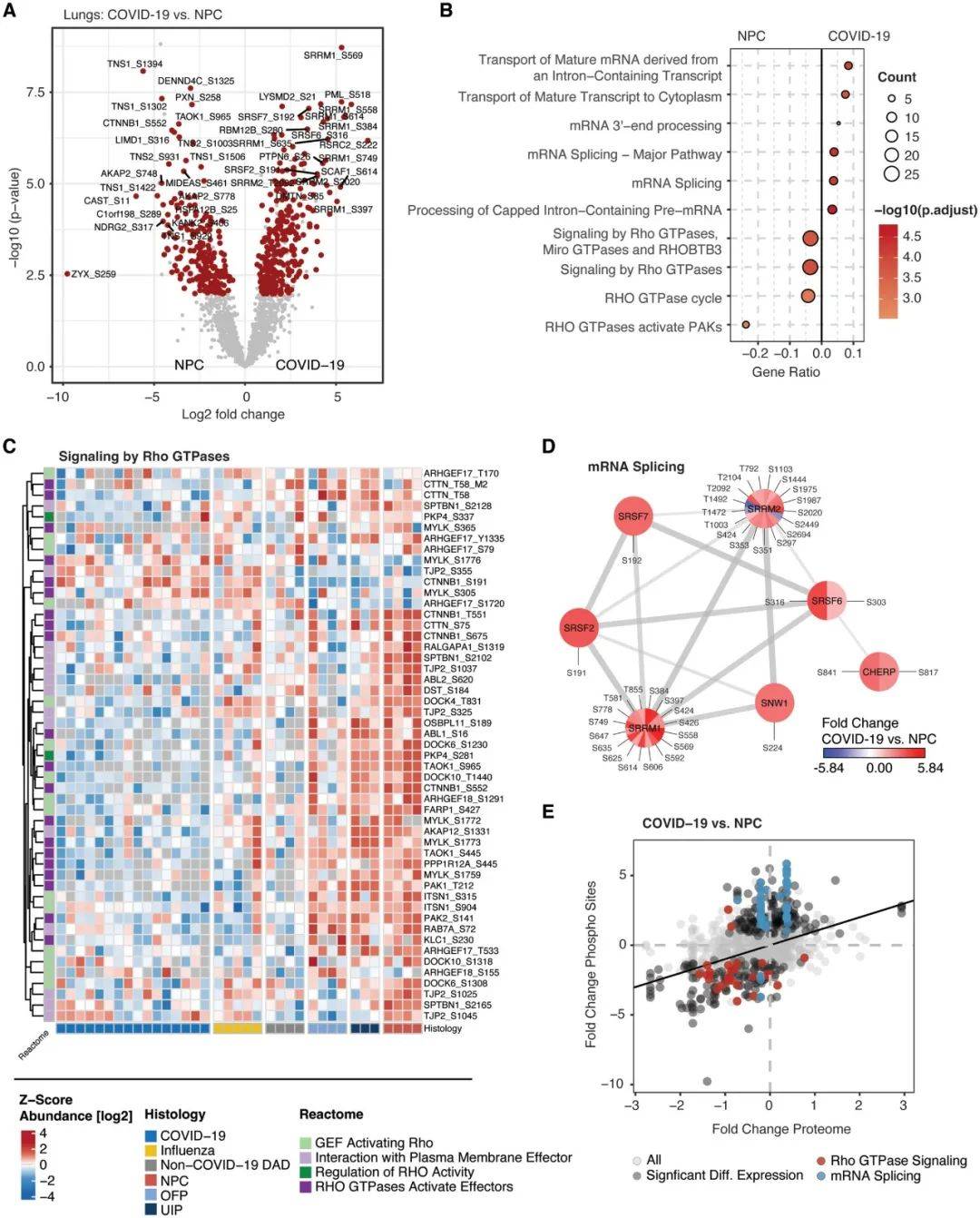 图5 感染诱导的肺部磷酸化信号传导(图源:Schweizer L, et al. EMBO Mol Med. 2023)
图5 感染诱导的肺部磷酸化信号传导(图源:Schweizer L, et al. EMBO Mol Med. 2023)
05.COVID-19 中的器官特异性影响
本研究进一步分析了SARS-CoV-2 感染后的全器官反应。如图6A、6B所示,对COVID-19和对照样本的主动脉/血管壁以及淋巴结组织进行了差异蛋白的筛选。富集分析,发现细胞周期检查点等过程在淋巴结、肺中上调,白细胞介素12信号在淋巴结中显着减少,肺、肾脏和肝脏中抗原加工交叉呈递、吞噬作用相关的蛋白质丰度增加(图6C-H)。
 图6 COVID-19 中的器官特异性影响(图源:Schweizer L, et al. EMBO Mol Med. 2
图6 COVID-19 中的器官特异性影响(图源:Schweizer L, et al. EMBO Mol Med. 2
06.COVID-19 对大脑的继发性炎症作用
由于 COVID-19 感染的一些症状表明神经系统恶化,为研究SARS-CoV-2 感染后死后阶段的大脑蛋白质组,本研究对脑干中基底神经节和延髓的FFPE样本进行定量分析,共7检测到4,000 多个蛋白质,并进行了差异蛋白表达分析(图7A-7C、7F)。富集分析发现,“AMPA受体的转运”在基底神经节中特异性地上调,表明炎症导致AMPA受体上调。此外,髓磷脂蛋白脂质蛋白 (PLP1) 和中性鞘磷脂酶 2 (SMPD3) 是COVID-19 延髓中下调幅度最大的蛋白之一,与大脑两个区域髓鞘碱性蛋白(MBP)的显著下调一致;相比之下,髓鞘-少突胶质细胞糖蛋白 (MOG) 是延髓中最显着上调的 COVID-19 蛋白之一(图7G)。由于PLP1在COVID-19的肺部也下调,表明这可能是免疫特权大脑中的继发性炎症作用。
 图7 COVID-19 对大脑的继发性炎症作用(图源:Schweizer L, et al. EMBO Mol Med.
图7 COVID-19 对大脑的继发性炎症作用(图源:Schweizer L, et al. EMBO Mol Med.
三、拜谱小结
本研究对COVID-19多器官FFPE样本进行了蛋白质组学分析,概括了全身炎症反应对跨器官病毒感染的主要作用,并将其与器官特异性效应分开。在肺组织中,COVID-19 引起的损伤最为广泛,与其他破坏性肺部疾病有相似之处和不同之处。几种组织类型在响应 SARS-CoV-2感染时表现出独特的特征,对肾脏、肝脏、淋巴和血管系统的直接和间接影响及大脑中的继发性炎症效应均体现了COVID-19的多器官损害。
石蜡切片作为医学中的常见样本,样本优势突出,储量丰富,应用范围广,可用于生物标志物研究、疾病分型、机制研究等。针对石蜡切片样本的特性,拜谱生物对切片脱蜡、蛋白提取、肽段酶解、上机测试等全流程进行优化,并结合全新一代Astral质谱,推出了超高深度FFPE蛋白质组学解决方案,助力科研工作者利用FFPE样本进行基础、临床研究,欢迎咨询!
参考文献:Schweizer L, Schaller T, Zwiebel M, Karayel Ö, Müller-Reif JB, Zeng WF, Dintner S, Nordmann TM, Hirschbühl K, Märkl B, Claus R, Mann M. Quantitative multiorgan proteomics of fatal COVID-19 uncovers tissue-specific effects beyond inflammation. EMBO Mol Med. 2023 Sep 11;15(9):e17459. doi: 10.15252/emmm.202317459. Epub 2023 Jul 31.