

在肝癌(HCC)研究中,高饱和脂肪酸(SFA)饮食如何促进HCC发生发展的分子机制尚未可知。传统研究多集中于代谢紊乱与炎症通路,缺乏对蛋白翻译后修饰在此过程中作用的深入解析。
2025年8月11日,中南大学湘雅二医院金鑫教授团队在Adv. Sci杂志上发表题为“ZDHHC12 Palmitoylates HDAC8 to Promote the Progression of Hepatocellular Carcinoma Associated with a Diet High in Saturated Fatty Acids”的文章。首次揭示棕榈酸(PA)通过激活SMARCA4转录上调棕榈酰转移酶ZDHHC12,进而催化HDAC8第244位半胱氨酸棕榈酰化并抑制其溶酶体降解,最终驱动HCC进展的分子机制。该发现为高SFA饮食相关肝癌的靶向治疗提供了新策略。拜谱生物为该研究提供了蛋白质组学和棕榈酰化修饰组学技术服务。

英文标题:ZDHHC12 Palmitoylates HDAC8 to Promote the Progression of Hepatocellular Carcinoma Associated with a Diet High in Saturated Fatty Acids
中文标题:ZDHHC12 通过棕榈酰化 HDAC8 促进与高饱和脂肪酸饮食相关的肝细胞癌进展
客户单位:中南大学湘雅二医院
研究材料:肝癌组织和细胞样本
拜谱提供技术:蛋白质组学、棕榈酰化修饰组学
技术路线:
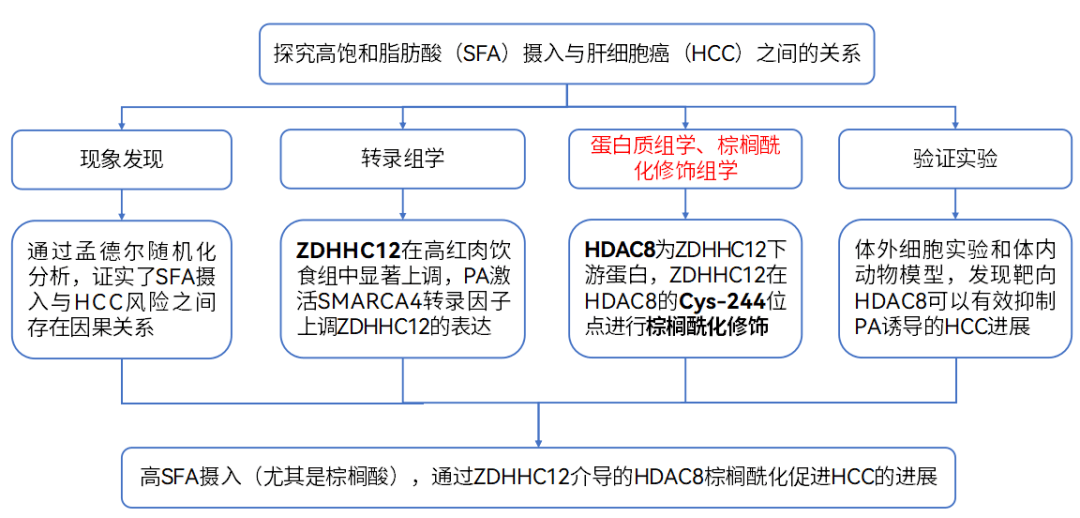
研究结果
ZDHHC12是PA诱导HCC的关键因子
孟德尔随机化(MR)分析证实SFA摄入显著增加HCC发病风险(图1b-c)。转录组测序比较高红肉饮食与正常饮食HCC患者样本,发现ZDHHC12表达上调最为显著(图1h)。体内外实验表明,PA可促进HCC细胞增殖(图1i-j),而敲低ZDHHC12则显著抑制PA的促癌效应(图1m-o)。ZDHHC12基因敲除小鼠在高PA饮食下肝癌发生明显减弱(图1t-u),证实ZDHHC12是PA驱动HCC进展的关键介质。
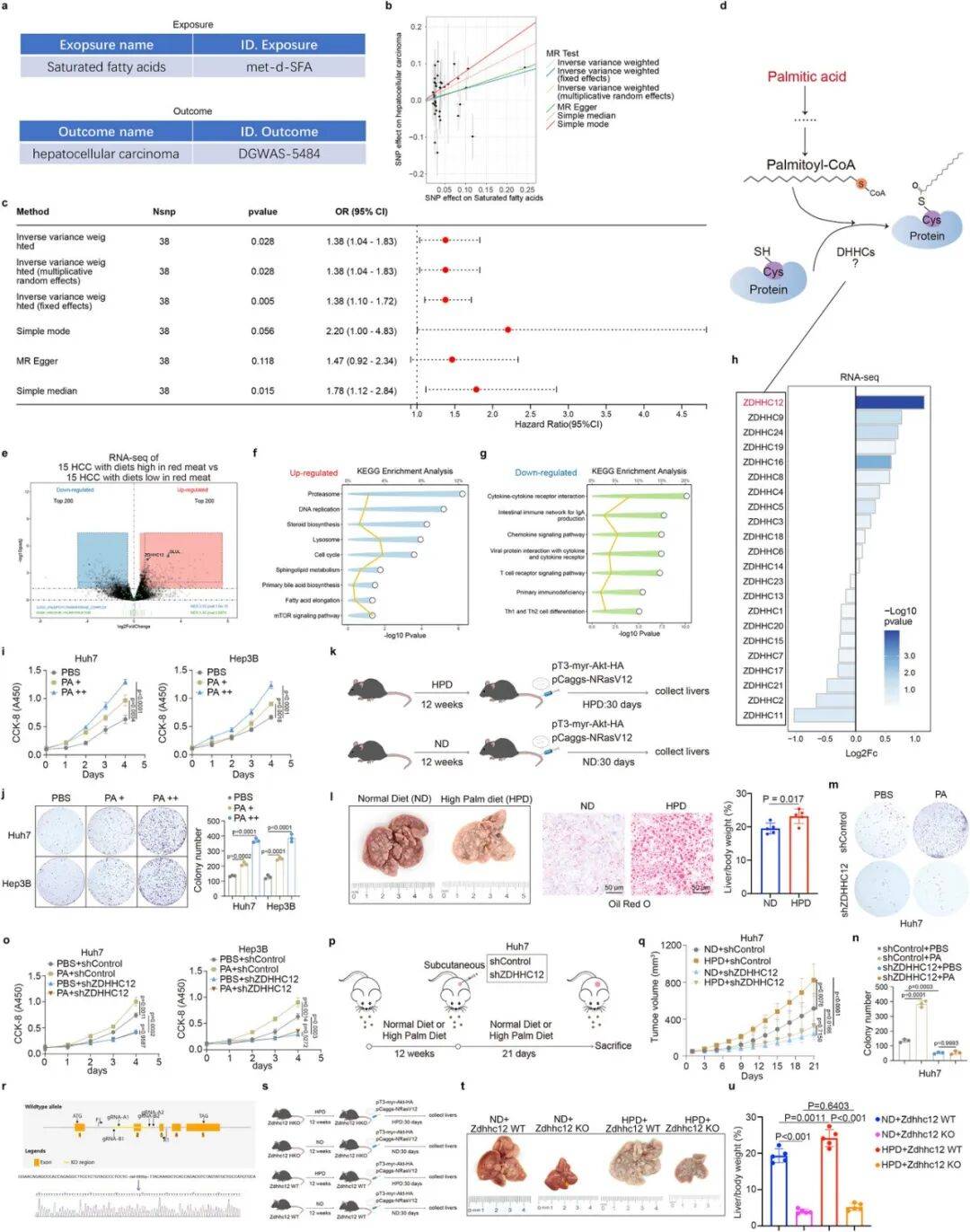 图1 ZDHHC12在PA诱发的HCC中起关键作用
图1 ZDHHC12在PA诱发的HCC中起关键作用
PA-SMARCA4轴激活ZDHHC12表达
功能实验表明,SMARCA4可结合ZDHHC12启动子并激活其转录(图2k-r),且两者在多种癌症中表达呈正相关(图2j)。此外,PA通过Wnt信号通路激活下游转录因子SP5,进而上调SMARCA4。
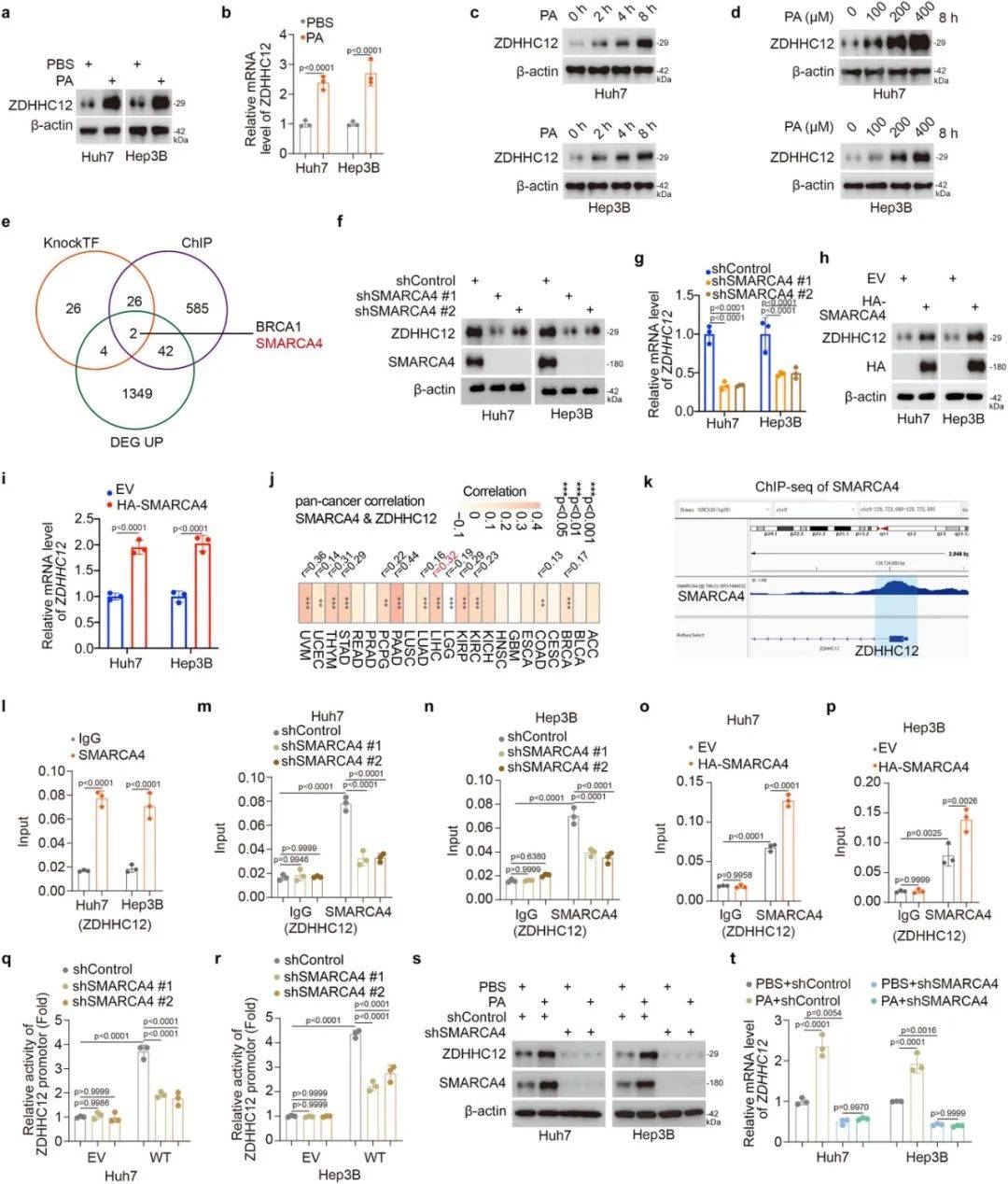 图2 PA通过SMARCA4上调ZDHHC12
图2 PA通过SMARCA4上调ZDHHC12
HDAC8是ZDHHC12的关键作用底物
蛋白质组学与免疫共沉淀技术分析显示,HDAC8为ZDHHC12的关键相互作用蛋白(图3a-d),二者可直接结合(图3e-m),且ZDHHC12敲低不影响HDAC8 的mRNA水平,但显著降低其蛋白稳定性(图3n-o)。
 图3 HDAC8是ZDHHC12促进HCC的下游因素
图3 HDAC8是ZDHHC12促进HCC的下游因素
C244位点棕榈酰化修饰的特异性验证
棕榈酰化修饰组学分析出HDAC8第244位半胱氨酸(Cys244)为棕榈酰化位点。功能实验表明,野生型ZDHHC12可恢复HDAC8棕榈酰化,而催化失活突变体(ZDHHC12 C127S)或HDAC8 C244S突变体均无法实现这一修饰(图4p-q),明确ZDHHC12是HDAC8 C244位点的特异性棕榈酰转移酶。
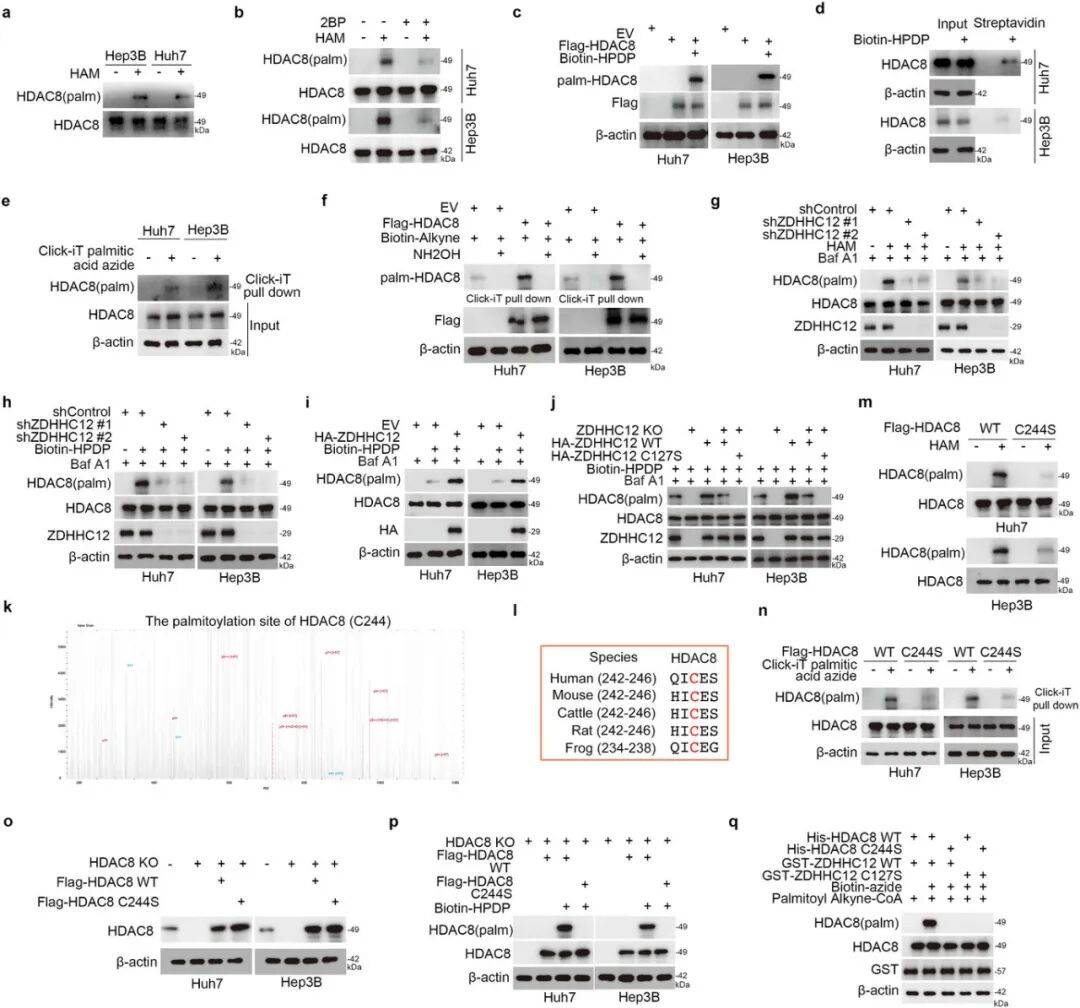 图4 ZDHHC12催化Cys244处HDAC8的棕榈酰化
图4 ZDHHC12催化Cys244处HDAC8的棕榈酰化
棕榈酰化抑制HDAC8溶酶体降解途径
实验表明,ZDHHC12介导的棕榈酰化可减弱HDAC8与HSC70的结合(图5n),从而抑制其溶酶体途径降解。在ZDHHC12敲低背景下,HDAC8 Cys244突变体与野生型HDAC8的稳定性无差异(图5h-i),表明棕榈酰化修饰是其逃避降解的关键。这一发现揭示了蛋白质棕榈酰化调控蛋白稳定性的新机制。
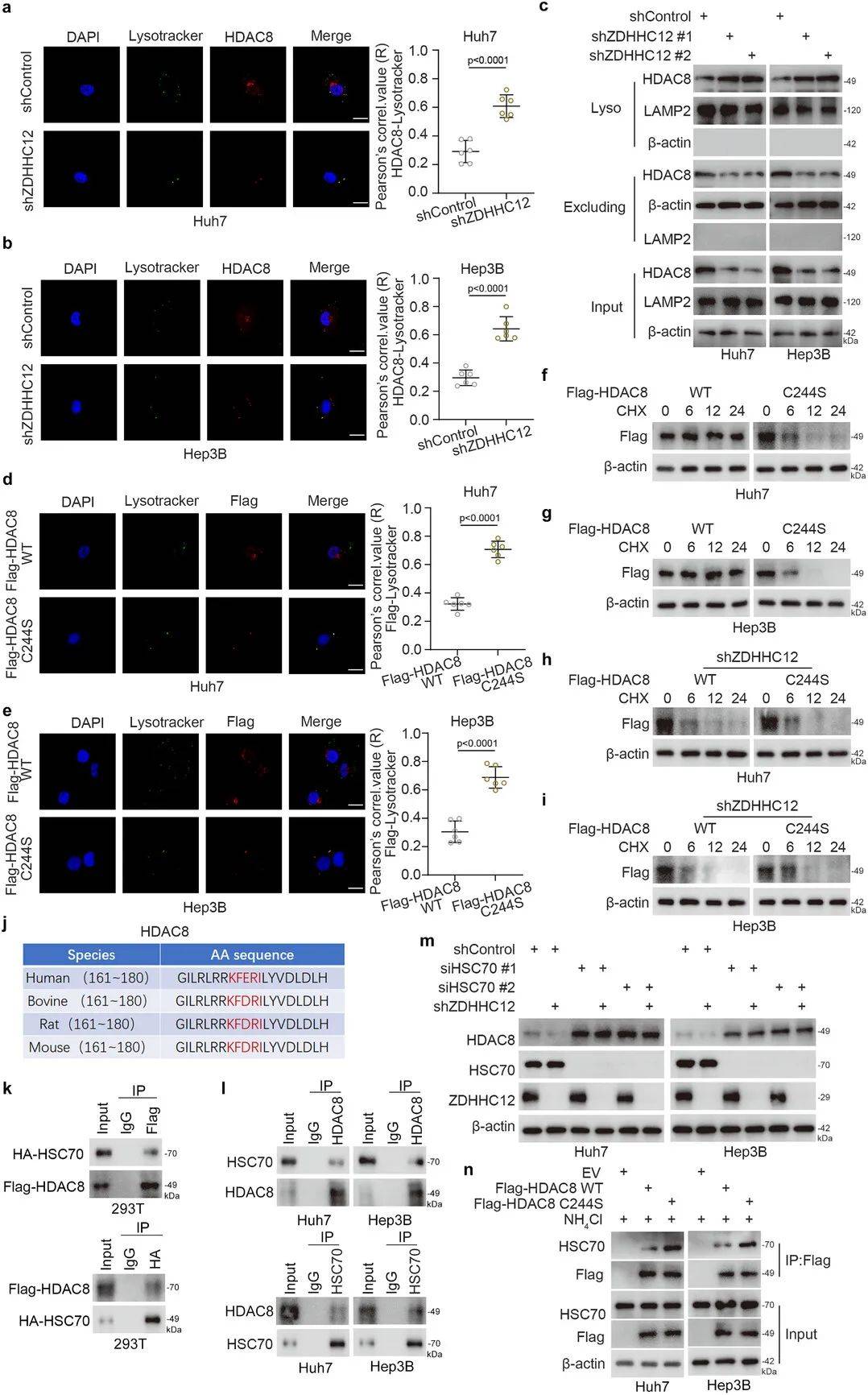 图5 Cys244的HDAC8棕榈酰化通过溶酶体途径抑制其降解
图5 Cys244的HDAC8棕榈酰化通过溶酶体途径抑制其降解
HDAC8靶向抑制剂的治疗潜力评估
使用选择性抑制剂PCI-34051处理可显著抑制HDAC8下游致癌通路,并在高PA饮食的CDX和PDX模型中有效抑制肿瘤生长(图6a-h)。遗传学实验进一步显示,Hdac8敲除可完全阻断高PA饮食的促瘤效应(图6m-o),且不受ZDHHC12状态影响。这些结果明确HDAC8是干预高PA饮食相关HCC的有效靶点。
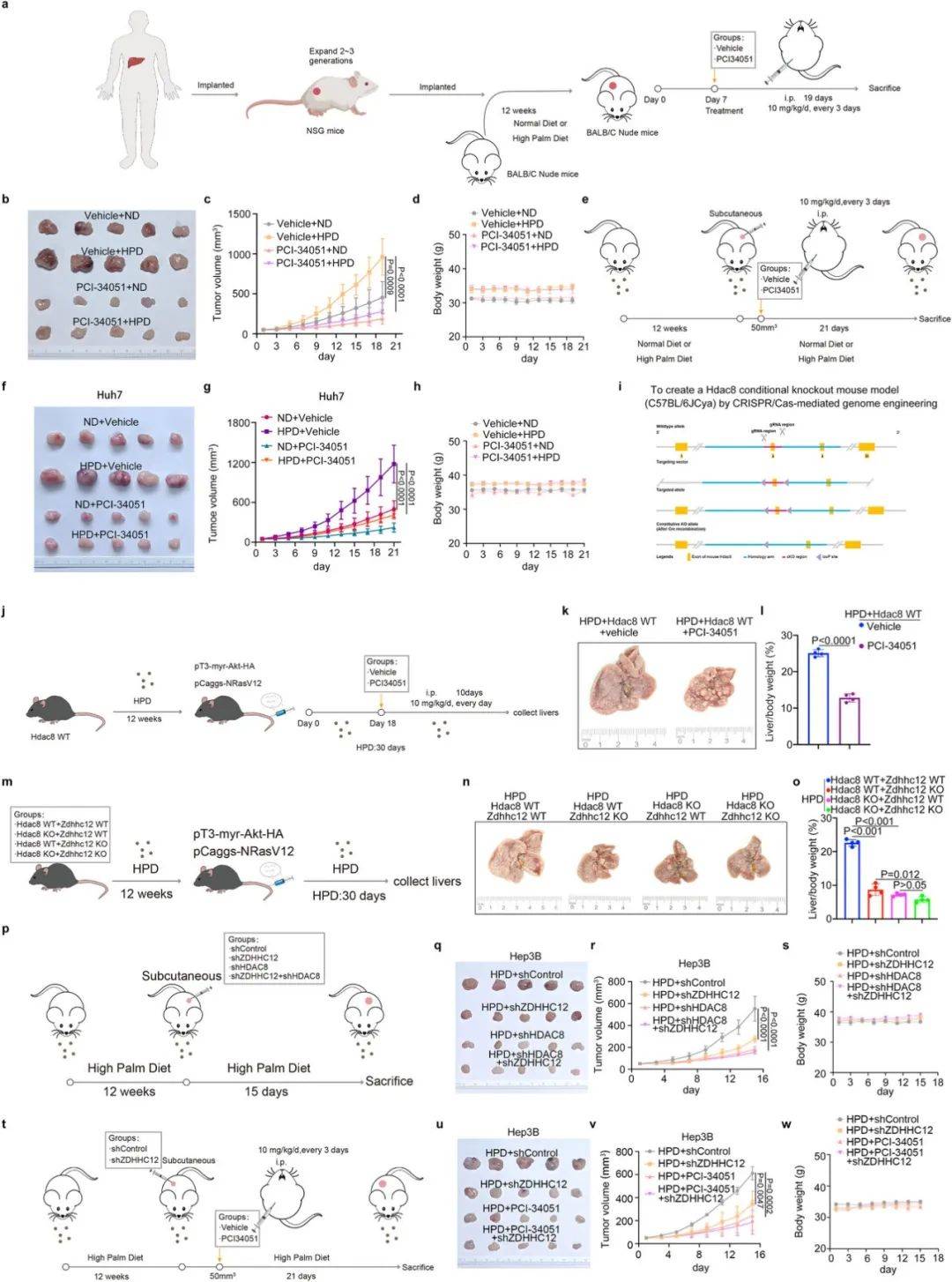 图6 靶向HDAC8可能是高PA饮食引起的HCC的一种治疗选择
图6 靶向HDAC8可能是高PA饮食引起的HCC的一种治疗选择
文章小结
本研究系统揭示了从PA摄入到HCC发生的分子通路:PA通过Wnt/SP5/SMARCA4轴转录上调ZDHHC12,后者催化HDAC8 C244位点棕榈酰化,抑制其与HSC70结合和溶酶体降解,从而增强HDAC8的稳定性并促进肝癌进展。该工作不仅深化了对饮食-代谢-表观遗传交叉调控网络的理解,也为高SFA饮食相关肝癌患者提供了靶向HDAC8的精准治疗策略。
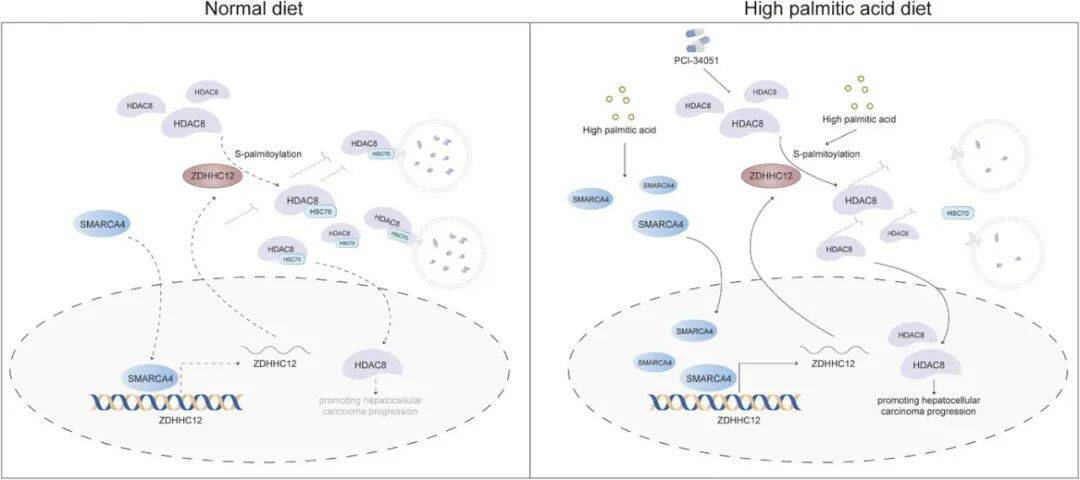 图7 PA通过ZDHHC12介导HDAC8棕榈酰化促进HCC进展的机制图
图7 PA通过ZDHHC12介导HDAC8棕榈酰化促进HCC进展的机制图
拜谱小结
本研究首次揭示“PA → SMARCA4 → ZDHHC12 → HDAC8棕榈酰化→HCC进展” 的分子轴,填补高SFA饮食促HCC的机制空白。该研究成果中拜谱生物为其提供蛋白质组学和棕榈酰化修饰组学技术支持。拜谱生物可提供产品最全面、技术体系最成熟的半胱氨酸修饰系列产品,包括棕榈酰化、亚硝基化、谷胱甘肽化、硫巯基化、次磺酸化、氧化还原、游离巯基,助力一系列文章发表。其中棕榈酰化修饰组学是我司首家推出、国内唯一成熟商业化的重磅特色产品,积累了丰富的项目经验,欢迎大家咨询!
参考文献:
Jin X, Hong Y, Zhao Y, et,al. ZDHHC12 Palmitoylates HDAC8 to Promote the Progression of Hepatocellular Carcinoma Associated with a Diet High in Saturated Fatty Acids. Adv Sci (Weinh). 2025 Aug 11:e05702. doi: 10.1002/advs.202505702.