

苯并[a]芘(BaP)是碳不完全燃烧产生的代表性环境污染物,因其对生物体的致癌性、致畸性和致突变性而闻名,主要暴露途径包括香烟烟雾、汽车尾气或烧烤食品等。乳酸化是一种新型翻译后修饰,在许多细胞过程中作为表观遗传调节因子起着至关重要的作用。然而,乳酸化在BaP诱导的细胞衰老和慢性阻塞性肺疾病(COPD)中的作用尚未阐明。
2025年6月26日,安徽医科大学第二附属医院付林教授团队在Journal of Hazardous Materials杂志上发表题为“AhR-mediated histone lactylation drives cellular senescence during benzo[a]pyrene-evoked chronic obstructive pulmonary disease”的研究文章。明确了BaP对COPD样肺部病变的影响以及BaP诱导的COPD期间肺上皮细胞衰老的作用。拜谱生物为该研究提供了乳酸化修饰组学技术服务。

英文标题:AhR-mediated histone lactylation drives cellular senescence during benzo[a]pyrene-evoked chronic obstructive pulmonary disease(Journal of Hazardous Materials IF:11.3)
中文标题:AhR介导的组蛋白乳酸化驱动苯并[a]芘诱发的慢性阻塞性肺疾病期间细胞衰老
客户单位:安徽医科大学第二附属医院
研究材料:细胞
拜谱提供技术:乳酸化修饰组学
技术路线:

研究结果
1. 慢性BPDE暴露诱导肺上皮细胞和小鼠肺细胞衰老
研究人员首先在小鼠中测定慢性BPDE(BaP的终产物)暴露对COPD的影响,结果发现以最大呼气中期流量(MMF)和呼气峰流量(PEF)降低为表现的小气道阻塞。
随后通过转录组学探索慢性BPDE诱发COPD的机制,共鉴定出515个上调基因(图1A)。GO和KEGG分析表明大多数DEGs与细胞周期和细胞衰老密切相关(图1B-C)。通过染色等技术确定BPDE暴露显著增加了小鼠肺中的细胞衰老(图1DF和G)。上述结果证明慢性BPDE暴露诱导肺上皮细胞和小鼠肺细胞衰老。
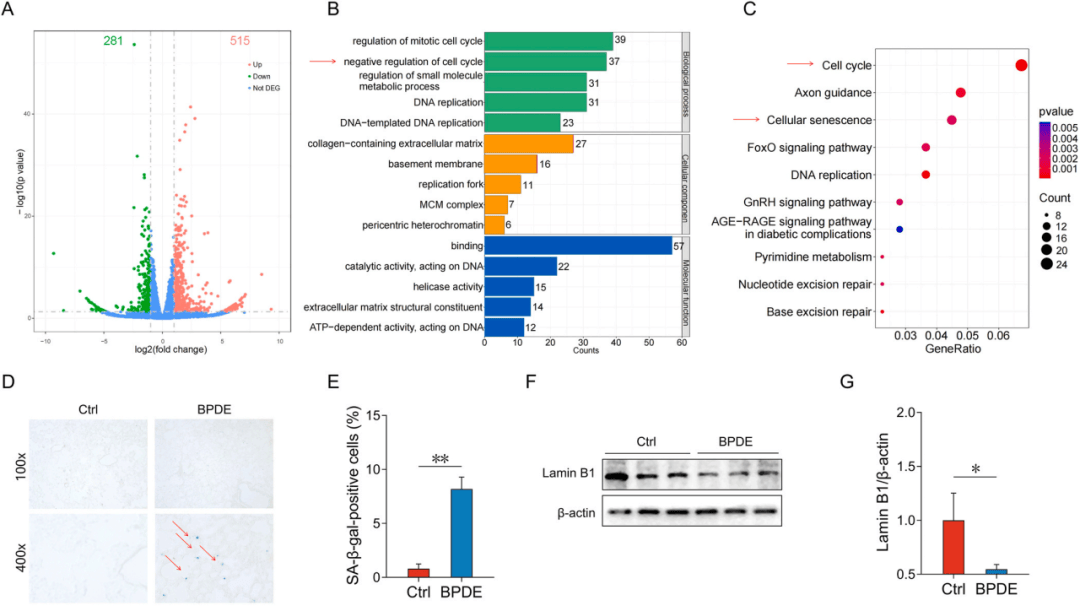 图1 慢性BPDE暴露对细胞衰老的影响
图1 慢性BPDE暴露对细胞衰老的影响
2. 慢性BPDE暴露促进肺上皮细胞和小鼠肺中乳酸的生成和乳酸化
研究人员为了探索细胞周期停滞的机制,收集了小鼠肺组织进行蛋白质组学分析(图2A)。GO和KEGG分析显示,BPDE暴露主要与各种代谢通路过程相关(图2B-C)。测定乳酸水平发现BPDE暴露后,小鼠肺组织中的乳酸浓度、赖氨酸乳酸化(Pan-Kla)水平会升高(图2D-J),并且在MLE-12细胞中,BPDE暴露从12小时到48小时促进LDHA和 LDHB的表达(图2K-L)。
 图2 BPDE暴露对乳酸生成和乳酸化的影响
图2 BPDE暴露对乳酸生成和乳酸化的影响
3. 慢性BPDE暴露诱导肺上皮细胞和小鼠肺组织中组蛋白H4K12乳酸化
乳酸化修饰组学分析显示,暴露于BPDE后,在MLE-12细胞中共鉴定到638种蛋白质,479个乳酸化位点,其中327个是可靠的乳酸化。乳酸化修饰的蛋白存在于多种细胞器中(图3A-B)。进一步分析发现,BPDE暴露后的MLE-12细胞中,11种蛋白的乳酸化水平升高,尤其组蛋白H4K12显著升高(图3C-D)。WB实验证实了这一结论(图3F-I)。并且受BPDE暴露的小鼠肺部H4K12乳酸化阳性细胞核的数量增加(图3J)。这些数据表明,暴露于BPDE后,肺上皮细胞中的组蛋白H4K12乳酸化增加。
 图3 BPDE暴露对组蛋白乳酸化的影响
图3 BPDE暴露对组蛋白乳酸化的影响
4. LDHB介导的组蛋白H4K12乳酸化参与BPDE诱发的肺上皮细胞衰老
如图4A-E所示,用乳酸脱氢酶抑制剂草氨酸钠(OXA)预处理可显著抑制BPDE介导的小鼠肺中乳酸、LDHB和Pan-Kla的增加。补充OXA可逆转BPDE诱导的小鼠肺中H4K12la和p53的增加(图4F-J)。用OXA预处理减轻了BPDE暴露的MLE-12细胞中LDHB、Pan-KLA、H4K12la和p53的增加(图4N-U)。通过OXA预处理,MLE-12细胞中细胞周期相关mRNAs表达的增加被逆转(图4V)。
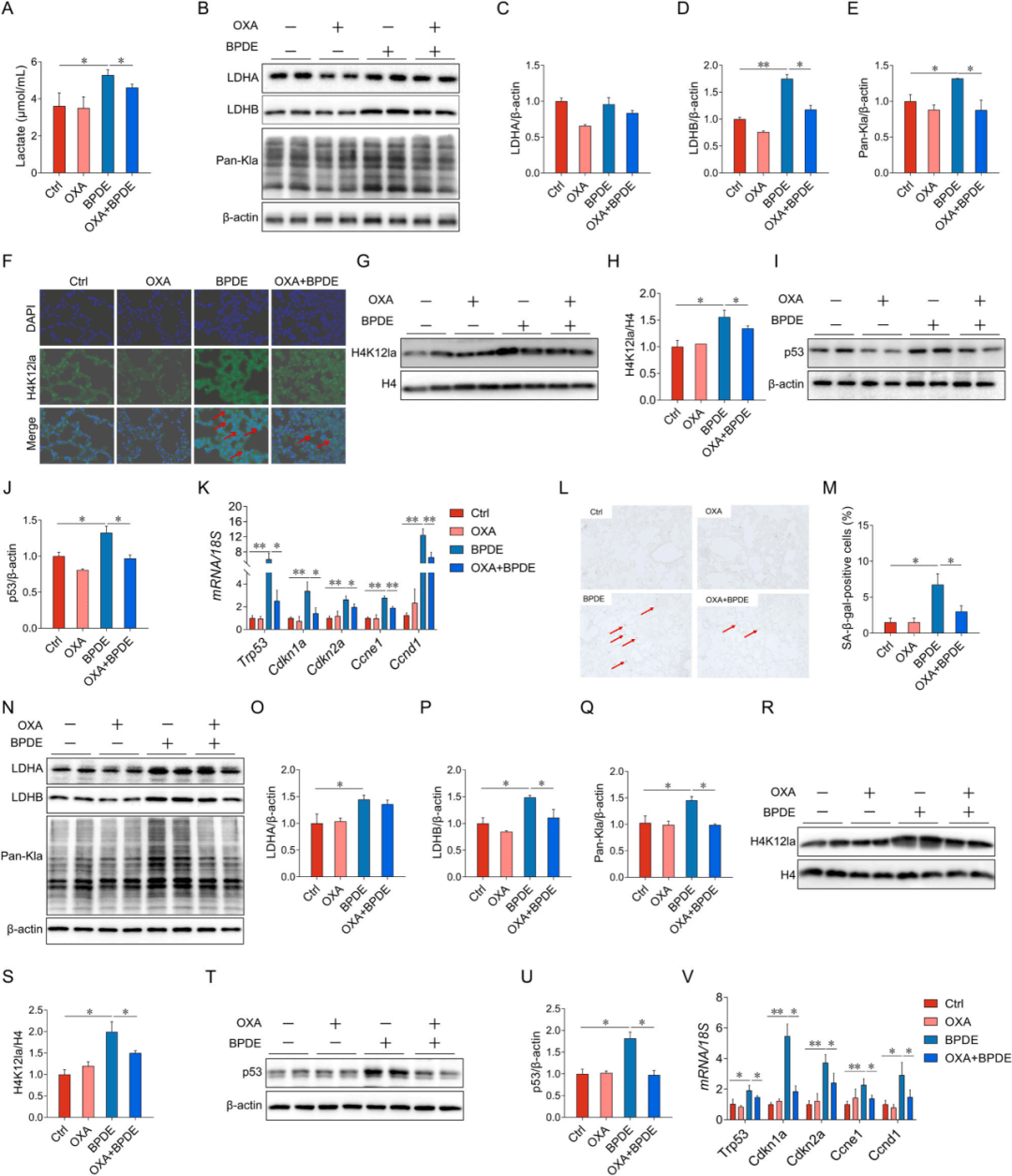 图4 OXA对BPDE诱导的细胞衰老的影响
图4 OXA对BPDE诱导的细胞衰老的影响
文章小结
本研究系统阐明了 BaP 通过 AhR 介导的组蛋白 H4K12 乳酸化诱导肺上皮细胞衰老,最终引发 COPD 的分子机制(图5),这些发现提高了对环境污染物BaP与呼吸系统疾病关联性的认识,为探索BaP通过肺上皮细胞中组蛋白乳酸化诱导的细胞衰老机制开辟了一条途径,并为 COPD 的预防和治疗提供了潜在靶点。
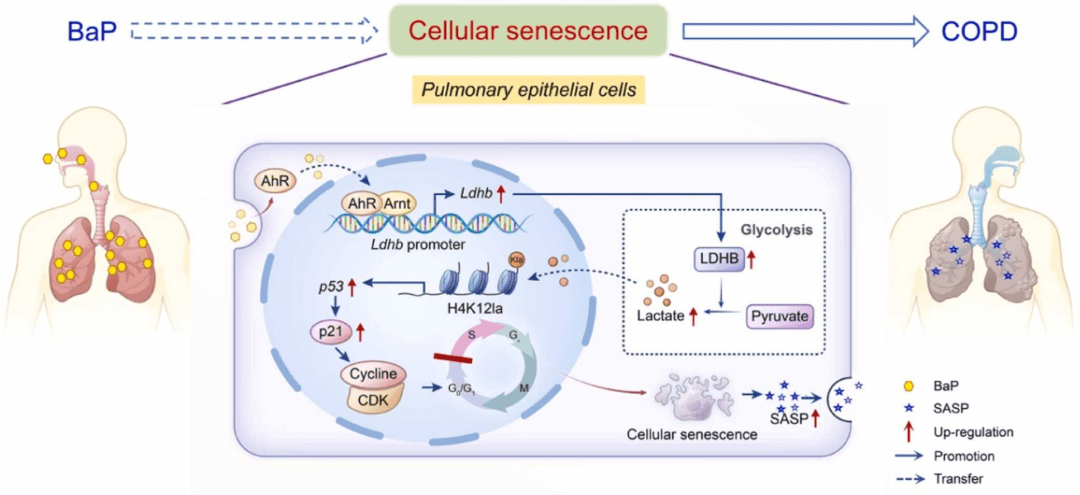 图5 BaP诱发的肺上皮细胞衰老和COPD的分子机制
图5 BaP诱发的肺上皮细胞衰老和COPD的分子机制
拜谱小结
本研究揭示了BaP通过AhR/LDHB/H4K12la/p53信号轴诱导肺上皮细胞衰老,最终导致COPD的分子机制,为COPD的预防和治疗提供了潜在靶点。本研究的乳酸化修饰组学技术服务由拜谱生物提供。作为国内多组学服务领域的领先企业,拜谱生物拥有完善成熟的蛋白质组学、修饰蛋白质组学、代谢组学、转录组学等多组学产品技术服务体系,拜谱生物乳酸化修饰组学,依靠自研抗体,特异性富集乳酸化修饰肽段,结合尖端质谱,实现万级乳酸化修饰位点检出,全面解析疾病机制机理,助力高分文章发表。现在咨询,您将有机会参加拜谱生物自研乳酸化泛抗体免费试用活动。
参考文献:Chen LH, Wei JP, Li MD, et al. AhR-mediated histone lactylation drives cellular senescence during benzo[a]pyrene-evoked chronic obstructive pulmonary disease. J Hazard Mater. 2025. doi:10.1016/j.jhazmat.2025.139083