

01、血清素化修饰背景
血清素(serotonin),又名5-羟色胺(5-HT)是传统的神经递质和激素,主要在大脑神经元和消化道内壁的肠嗜铬细胞中合成,分布在中枢神经系统和外周系统。血清素通过与不同受体结合参与调节多种基础生理和病理过程。在中枢神经系统,5-HT能调节记忆、情绪、睡眠、食欲、感知温度等认知和生理功能;在外周系统,5-HT参与血小板凝固、胃肠道功能、骨骼形成、能量平衡、胰岛素分泌、组织再生以及免疫力等[1]。
除了经典的受体介导的生物功能,近年来的研究发现5-HT还能通过蛋白质翻译后修饰,即血清素化修饰(serotonylation),影响蛋白的功能,从而参与下游的调控作用。血清素化修饰是在谷氨酰转氨酶(TGMs)的作用下,血清素与蛋白质谷氨酰胺位点发生的共价修饰(图1)。当前在人体中发现了至少8种不同的TGMs(TGM1-TGM7,因子XIII),其中研究最多的是TGM2,该蛋白在人体组织中广泛表达。
 图1 血清化修饰的生化途径
图1 血清化修饰的生化途径
(图源:Jiang, et al., Journal of Cell Science, 2021)
目前报道的血清素化修饰底物包括小GTP酶(Rab3a, Rab27a, Rab4, RhoA, Rac1和Cdc42)、细胞外基质蛋白纤连蛋白、细胞骨架蛋白、组蛋白等(图2)。血清素化修饰参与血小板激活、平滑肌收缩、胰岛素释放、免疫耐受等生理功能,并与癌症、神经性疾病、高血压、糖尿病等疾病的进展密切相关。目前,关于血清素化修饰的研究还在不断深入,其具体的分子机制和生物学功能尚有很多未知领域,需要进一步的研究来揭示。了解血清素化修饰的生物学意义对于开发相关疾病的治疗方法具有重要意义。
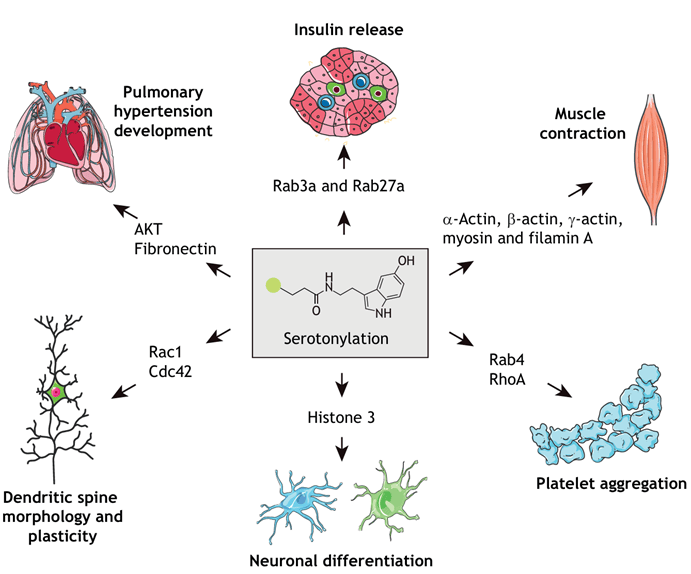 图2 血清化修饰的底物及参与的生物学功能
图2 血清化修饰的底物及参与的生物学功能
(图源:Jiang, et al., Journal of Cell Science, 2021)
02、血清素化修饰检测方法
血清素化修饰检测方法主要包括免疫法和质谱法,或者二者结合使用。
(1)利用位点特异性抗体检测目标蛋白的修饰水平,例如2019年Nature上发表的首次发现H3组蛋白血清素化修饰参与基因表达调控的论文,作者利用H3Q5ser位点特异性抗体检测了H3的血清素化修饰水平,并利用LC-MS/MS对免疫沉淀的蛋白进行鉴定,从而确定了H3Q5血清素化修饰的存在(图3)。
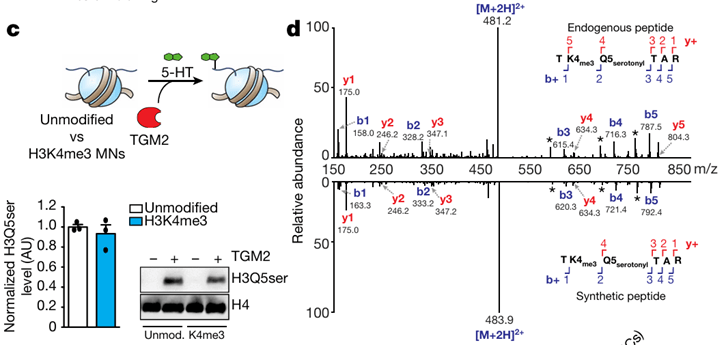 图3 组蛋白血清素化修饰的检测
图3 组蛋白血清素化修饰的检测
(图源:Farrelly, et al., Nature, 2019)
(2)利用化学蛋白质组学富集血清素化修饰的蛋白,通过质谱进行高通量检测。2014年Ching-Yao Lin等开发了一种含炔烃的血清素衍生物5-PT作为探针,然后通过化学点击连接上含生物素的标签,再利用链霉素对目标蛋白进行富集和切标签,最后利用质谱法对富集的蛋白进行检测(图4)[3]。该方法可以对组织或细胞样本中所有发生血清素化修饰的蛋白进行筛选,并获得精准的位点和定量信息,为候选分子机制的研究提供支持。
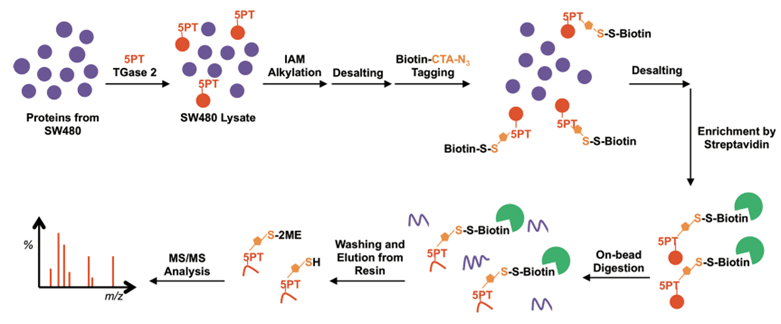 图4 化学蛋白质组学检测血清素化修饰的工作流程
图4 化学蛋白质组学检测血清素化修饰的工作流程
(图源:Ching-Yao Lin, et al., Journal of Proteome Research, 2015)
03、血清素化修饰的研究思路
接下来我们通过几篇高分论文看一下血清素化修饰的研究思路吧。
组蛋白血清素化修饰调控髓母细胞瘤的发生

本研究关注肿瘤和神经元之间的双向通讯在恶性肿瘤的肿瘤微环境中的作用,重点聚焦了肿瘤微环境的表观基因组失调和外源性神经元信号传导在髓母细胞瘤(EPN)进展中的作用机制。研究人员首先发现血清素能神经元能调控EPN肿瘤的发生。基于先验知识,作者研究了组蛋白血清素化修饰(H3Q5ser)在EPN发生中的作用,并通过抑制血清素化修饰验证了神经元通过H3Q5ser调控EPN的发生。接着作者利用高通量筛选(Chip-seq等)研究了H3Q5ser调控的下游分子,结果发现转录因子ETV5能通过增强抑制性染色质状态促进EPN的进展。最后作者发现ETV5能调控神经肽Y(NPY)的表达,NPY通过突触重塑的机制抑制肿瘤进展。综上,本研究组蛋白血清素化是EPN发生的关键驱动隐私,还揭示了神经元信号传导、神经表观基因组学和发育程序如何交织在一起驱动脑癌的恶性肿瘤。
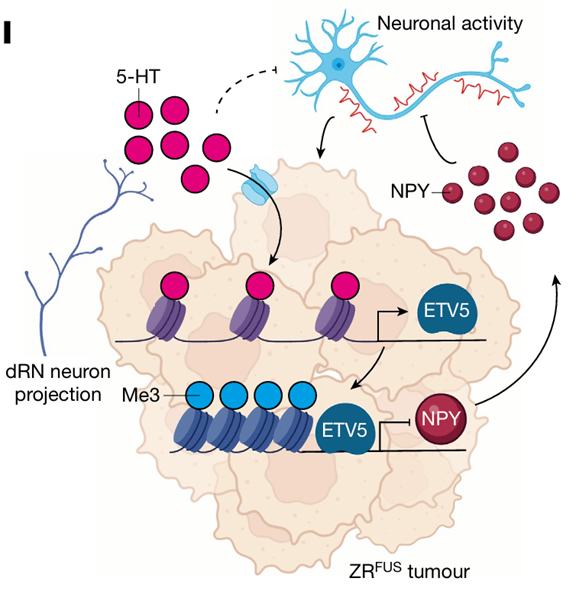 图5 神经元血清素调控肿瘤进展的模式图
图5 神经元血清素调控肿瘤进展的模式图
(图源:Chen, et al., Nature, 2024)
甘油醛-3-磷酸脱氢酶(GAPDH)血清素化修饰偶联CD8+T细胞糖酵解代谢和抗肿瘤免疫(IF 14.5)

研究人员发现了一种甘油醛-3-磷酸脱氢酶(GAPDH)的血清素化翻译后修饰机制,可促进CD8+ T细胞的糖酵解代谢和抗肿瘤免疫活性。 研究人员首先发现血清素可以直接促进αCD3/αCD28刺激的CD8 + T细胞的增殖,然后 通过化学蛋白质组学筛选到GAPDH是血清素修饰的底物蛋白 ,且GAPDH的血清素化修饰与活化的CD8+T细胞中糖酵解代谢的增强有关。 为确定GAPDH上的血清素化位点,作者进行了LC-MS/MS质谱分析,结果显示在合成的小鼠GAPDH肽中,46、76、183、202和262位的Gln残基可以发生血清素化修饰,并通过实验验证Q262位点血清素化修饰的关键作用。 研究人员随后通过一系列分析工作发现了组织谷氨酰胺转氨酶2(TGM2)介导的血清素化修饰、血清素合成、血清素转运、血清素降解等血清素修饰体系在CD8 + T细胞活化和抗肿瘤免疫中的作用。 为了评估CD8 + T细胞血清素修饰在肿瘤免疫治疗中的治疗潜力,研究了其在嵌合抗原受体T(CAR-T)细胞抗肿瘤功效中的作用,发现在CAR-T细胞中过表达TPH1产生血清素可提高抗肿瘤疗效。 该研究中拜谱生物为其提供LC-MS/MS质谱分析,鉴定出CD8+ T细胞中的发生血清素化蛋白以及确定GAPDH上发生血清素化修饰位点。
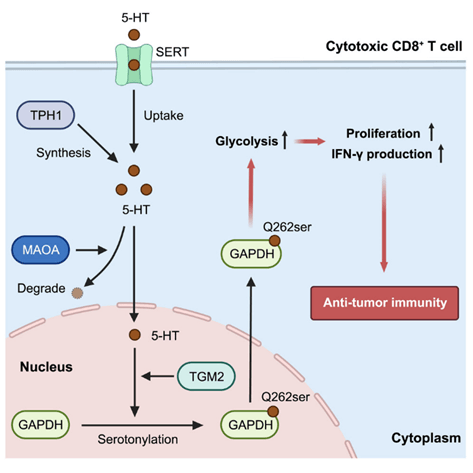 图6 GAPDH血清素化调控CD+8 T细胞抗肿瘤免疫的模式图
图6 GAPDH血清素化调控CD+8 T细胞抗肿瘤免疫的模式图
(图源:Wang, et al., Molecular Cell, 2024)
肿瘤相关成纤维细胞的血清素化修饰促进结直肠癌进展(IF 9.1)

前期研究强调了血清素在结直肠癌(CRC)中等癌症生物学中的不同作用。虽然血清素主要通过与各种血清素受体结合发挥作用,但不依赖受体的机制如血清素翻译后修饰在CRC进展中的作用机制仍不清楚。本研究表明,通过基因沉默5-HT合成酶Tph1或使用选择性Tph1抑制剂来,可有效降低结直肠癌肿瘤的生长。有趣的是,尽管CRC中存在内在的5-HT合成,但是循环的5-HT介导了5-HT的促癌功能。阻断5-HT受体的功能表明5-HT在CRC中的致癌作用是通过与其受体分离的机制运作的。相反,在结直肠癌细胞和癌症相关成纤维细胞(CAFs)中发现了组蛋白H3Q5 (H3Q5ser)的血清素化。H3Q5ser触发CAF向炎症样CAF(iCAF)亚型表型转换,进一步增强CRC细胞增殖、侵袭性特征和巨噬细胞极化。敲低5-HT转运体SLC22A3或抑制TGM2可降低H3Q5ser水平,逆转CRC中CAFs的促瘤表型。总的来说,这项研究揭示了5-HT在CRC进展中的5-羟色胺依赖机制,为针对CRC治疗的5-羟色胺途径的潜在治疗策略提供了见解[6]。
04拜谱小结
血清素化修饰作为一种新型蛋白翻译后修饰,是血清素发挥生物学功能的主要机制之一,已发现广泛参与癌症、神经性疾病、代谢性疾病的病理机制。血清素化修饰的靶蛋白包括组蛋白和非组蛋白,目前组蛋白主要集中H3Q5位点,该位点的血清素化修饰可触发下游一系列基因的转录;非组蛋白的血清素化修饰改变了底物的酶活性、细胞定位、蛋白互作、蛋白构象等,进而影响其参与的下游表型。当前血清素化修饰研究主要集中于发现更多的修饰底物并揭示其调控机制,另一方面基于血清素化修饰系统开发特异性的药物。
拜谱生物拜作为国内领先的多组学公司,可提供完善成熟的蛋白组学、代谢组学、转录组学等多组学产品技术服务体系。近期,拜谱生物推出了基于化学蛋白质组学的血清素化修饰组学产品,一方面可以从蛋白层面上筛选可能发生修饰的靶点并结合生物信息学分析获得靶点蛋白的功能信息,另一方面可以利用体外酶催化反应结合LCMS/MS方法对目标蛋白的修饰位点进行精准定位;同时,拜谱生物具有血清素的靶向代谢组学产品,结合标准品可实现样本中代谢物的绝对定量 ,为血清素作用机制研究提供帮助。欢迎感兴趣的老师致电咨询。
参考文献:
[1] Jiang SH, Wang YH, Hu LP, et al. The physiology, pathology and potential therapeutic application of serotonylation. J Cell Sci. 2021;134(11):jcs257337. doi:10.1242/jcs.257337B3
[2] Farrelly LA, Thompson RE, Zhao S, et al. Histone serotonylation is a permissive modification that enhances TFIID binding to H3K4me3. Nature. 2019;567(7749):535-539. doi:10.1038/s41586-019-1024-7B1
[3] Lin JC, Chou CC, Tu Z, et al. Characterization of protein serotonylation via bioorthogonal labeling and enrichment. J Proteome Res. 2014;13(8):3523-3529. doi:10.1021/pr5003438B2
[4] Chen HC, He P, McDonald M, et al. Histone serotonylation regulates ependymoma tumorigenesis. Nature. 2024;632(8026):903-910. doi:10.1038/s41586-024-07751-zB1
[5] Wang X, Fu SQ, Yuan X, et al. A GAPDH serotonylation system couples CD8+ T cell glycolytic metabolism to antitumor immunity. Mol Cell. 2024;84(4):760-775.e7. doi:10.1016/j.molcel.2023.12.015B1
[6] Ling T, Dai Z, Wang H, et al. Serotonylation in tumor-associated fibroblasts contributes to the tumor-promoting roles of serotonin in colorectal cancer. Cancer Lett. 2024;600:217150. doi:10.1016/j.canlet.2024.217150