

你是否曾在品尝美食时好奇,那些在我们肠道中辛勤工作的微生物是如何影响我们健康的?是否想过,我们所吃的食物如何在体内引发一场微生物的“变革”?最近,两项突破性的研究为我们揭示了肠道微生物与饮食中的化合物和药物之间的复杂关系,让我们对“内在世界”的理解更进一步。想象一下,当我们享用一顿丰盛的晚餐时,不仅是我们的味蕾在享受,我们肠道中的微生物也在进行一场热闹的“晚宴”。它们不仅参与食物的消化,还能将某些化合物转化为对我们有益的抗生素,或是将有害物质解毒。这些微生物与我们的饮食相互作用,共同塑造了我们的健康图景。
最新的科研发现中,研究者们通过深入的实验和分析,向我们展示了肠道微生物如何将我们摄入的化合物转化为影响我们健康的关键因素。这些发现不仅为我们打开了一扇了解肠道微生物世界的窗口,也为我们提供了调节肠道健康、预防疾病的新思路接下来,让我们一起探索这些令人兴奋的研究成果,了解肠道微生物如何成为我们健康的守护者,以及我们如何通过饮食来培养一个更健康的肠道环境。
01、膳食交响:肠道微生物的转化之舞
2024年9月24日,美国耶鲁大学的Andrew L. Goodman教授团队在Cell上发表了题为“Microbial transformation of dietary xenobiotics shapes gut microbiome composition”的研究论文。该研究精细绘制了超过150种小分子膳食异物的肠道微生物群互动图谱,深入探讨了这些化合物对微生物群落组成的影响、人体肠道微生物对这些异物的代谢过程,以及不同个体间的差异。研究揭示,微生物的代谢作用能够对这些化合物进行毒化与解毒,进而产生新的相互作用,阐释了膳食异物如何引导微生物群落的重塑过程。这一成果系统地展现了膳食异物与肠道微生物群之间的复杂互动,并将毒化与解毒过程与微生物群对膳食反应的个体差异紧密相连。

为了深入探究肠道微生物如何代谢膳食外源性物质,以及这些代谢产物如何影响细菌生长和群落结构,研究人员选取了29份来自健康捐献者的粪便样本,并与22种膳食外源性物质进行了体外共培养,运用代谢组学分析技术测量了化合物的代谢情况。结果显示,不同肠道微生物群落对各类化合物的代谢能力存在显著差异,这揭示了肠道微生物在代谢膳食外源性物质方面的多样性,这种多样性可能是导致个体间对膳食反应差异的关键因素。
进一步研究中,研究人员探讨了膳食外源性物质对肠道微生物群落组成的影响。通过将140种膳食外源性物质与四种不同的肠道微生物群落进行体外共培养,并采用16S rRNA测序技术分析了群落组成的变化,研究发现有25种化合物能够显著重塑至少一种肠道微生物群落,其中10种化合物甚至能同时影响所有四种群落,主要归因于这些化合物的毒性。因此,膳食外源性物质能够通过改变肠道微生物群落的组成,间接影响宿主的健康。
此外,研究人员还将94种膳食外源性物质与四种肠道微生物群落共培养,并提取了小分子物质,用于抑制七种代表性肠道共生菌的生长,旨在探讨肠道微生物如何改变膳食外源性物质的毒性。实验发现,有11种化合物在体外培养过程中被代谢产生了有毒的代谢产物,而它们的原始形态并不具备毒性。这些有毒代谢产物能够抑制肠道共生菌的生长,进而影响群落结构。这一发现表明,肠道微生物通过代谢作用能够转变膳食外源性物质的毒性,从而对肠道微生物群落的组成产生深远影响。
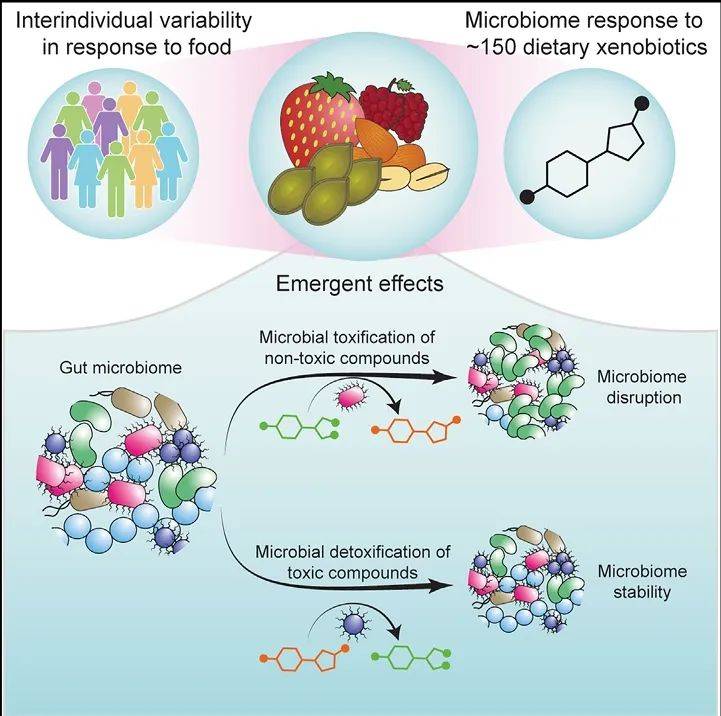 图1 机制图(图源:Elizabeth, et al., Cell, 2024)
图1 机制图(图源:Elizabeth, et al., Cell, 2024)
02、药物试炼:肠道菌群的应变之道
同日,Cell上发表了另一项由欧洲分子生物学实验室的Athanasios Typas教授团队领衔的研究,题为“Emergence of community behaviors in the gut microbiota upon drug treatment”,探讨了肠道菌群在药物处理下出现群落行为的机制。研究发现,与单一细菌相比,复杂的微生物群落可以保护其成员免受药物影响,或者使敏感的成员变得更加敏感。药物生物转化和生物积累是群落保护的关键机制,但在高药物浓度下会被破坏。这些发现有助于我们更好地理解药物-肠道菌群相互作用,并为设计更有效的药物和减少不良影响提供新的思路。

本研究旨在深入剖析药物对肠道菌群的影响,尤其是在复杂菌群环境中的具体作用机制。虽然药物已被证实能够直接抑制肠道细菌的生长,但其对整个肠道菌群的影响仍是一个未解之谜,且目前的研究主要局限于特定药物与特定菌群之间的相互作用。为了填补这一研究空白,研究人员精心构建了一个包含32种代表性肠道细菌物种的合成菌群,这些物种在健康人体肠道菌群中占据主导地位。同时,研究选取了30种具有代表性的药物进行系统筛选。通过将药物引入菌群并细致观察其对每个物种的影响,同时利用16S rDNA测序和代谢组学分析技术,研究发现有26%的药物-细菌相互作用中观察到了菌群行为的出现,表明药物在单一细菌与整个菌群环境中的影响存在显著差异。研究结果表明,在低药物浓度下,菌群展现出了更强的生存韧性,而在高药物浓度下,菌群的保护作用减弱,药物的敏感化作用则相应增强。药物在菌群中的转化和积累过程是菌群保护作用的关键所在,特定物种通过表达硝基还原酶来降解药物,从而保护整个菌群免受损害。综上所述,药物对肠道菌群的影响与对单一细菌的影响相似,但菌群行为的普遍性不容忽视,且菌群的韧性受到药物浓度的影响。深入理解特定物种对药物的解毒能力,对于设计更加稳定和高效的菌群,以减少药物副作用或提升药物治疗效果具有重要意义。
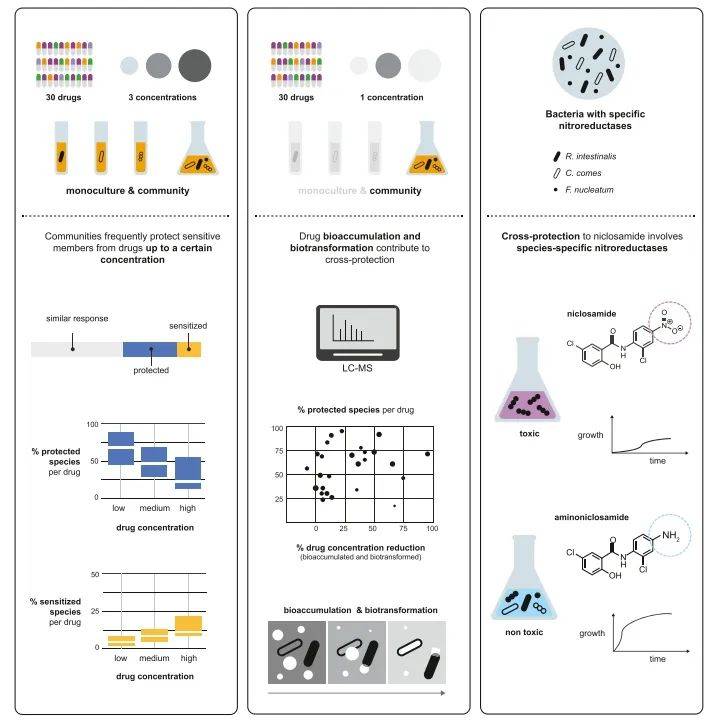 图2 流程图(图源:Sarela, et al., Cell, 2024)
图2 流程图(图源:Sarela, et al., Cell, 2024)
03、总结
随着这两项开创性研究的发布,让我们对肠道微生物群落如何影响我们对药物和饮食成分的反应有了更深入的认识。这些研究不仅揭示了肠道微生物在药物代谢和饮食异生物质转化中的关键作用,还强调了个体间差异在治疗和营养反应中的显著性。肠道微生物群落是我们健康的守护者,也是我们对药物和饮食反应的调节者。随着科学的进步,我们正逐步揭开它们如何塑造我们健康的神秘面纱。通过这些研究,我们期待能够实现更精准的医疗和饮食建议,为每个人提供最适合他们内在生态系统的健康方案。
04、拜谱小结
在这一微生物组学迅猛发展的背景下,拜谱生物致力于通过创新技术推动微生物组学研究的深入。在16s、宏基因组、宏转录组等“宏组学”系列产品的基础上,对微生物组研究推出的产品“深度宏蛋白质组”,通过全新Astral质谱平台对微生物组的蛋白质进行高通量定性和定量分析,实现万级超高深度蛋白鉴定,并提供菌群注释、蛋白定量分析、蛋白功能注释、差异蛋白分析和高级分析等丰富的生信分析结果,助力揭示复杂样本中微生物种群与共生协作关系。深度宏蛋白质组学可以把微生物群落的基因信息和功能信息进行关联,揭示群体中发挥关键作用的微生物和与其相关的蛋白质功能,在“肠脑轴”、发病机制研究、疾病分型研究等多领域具有广泛的应用。拜谱生物已建立了完善成熟的转录组学、蛋白组学、代谢组学以及多组学联合产品技术服务体系,助力高分文献发表,欢迎咨询!
参考文献:
1)Culp E, Nelson N, Verdegaal A, Goodman A. Microbial transformation of dietary xenobiotics shapes gut microbiome composition. Cell. 2024 Sep 24. doi: 10.1016/j.cell.2024.08.038.
2)Garcia-Santamarina S, Kuhn M, Devendran S, Maier L, Driessen M, Mateus A, Mastrorilli E, Brochado A, Savitski M, Patil K, Zimmermann M, Bork P, Typas A.Emergence of community behaviors in the gut microbiota upon drug treatment. Cell. 2024 Sep 24. doi: 10.1016/j.cell.2024.08.037.