

早产儿和肺部疾病患者的肺部通常会积累过多的液体,氧气治疗作为一种常规用药,可以通过增强气道功能起到挽救生命的作用,但是长期暴露于高氧会导致不可逆的肺损伤。虽然高氧的不良反应是由活性氧介导的,但高氧对肺中氧化还原依赖性调节的影响程度尚不清楚,s-谷胱甘肽化(SSG)对特定蛋白质的调控机制还未解析。
太平洋西北国家实验室生物科学部的Tong Zhang,等在Redox Biology发表了题为“Regulation of hyperoxia-induced neonatal lung injury via post-translational cysteine redox modifications”的文章。该研究在暴露于高氧环境下的Scnn1b过表达小鼠中观察到大量的SSG变化,这表明ENaC在细胞调节中起着至关重要的作用。通过TMT蛋白质组和谷胱甘肽修饰蛋白质组分析,发现Scnn1b过表达可能通过调节细胞粘附、凝血和蛋白水解等特定过程来保护高氧诱导的肺损伤。这项研究提供了肺中蛋白质氧化的全景视图,并强调了氧化还原调节在O2 诱导的肺损伤中的重要性。

文章名称: Regulation of hyperoxia-induced neonatal lung injury via post-translational cysteine redox modifications(Redox Biology, 2022, IF=11.4)
研究材料:Scnn1b过表达小鼠、野生型小鼠
组学技术:谷胱甘肽修饰蛋白质组、TMT蛋白质组
PART.01、研究思路

PART.02、研究结果
1.慢性高氧下新生儿转基因Scnn1b肺表型
为了验证上皮钠通道在减轻氧化损伤中起重要作用,研究者们进行了生化分析和质谱检测。如图1A-C所示,WT小鼠慢性吸入Fi O 2和Scnn1b过表达小鼠都可以增加破坏指数、嗜中性粒细胞浸润、氧化应激,而慢性高 O 2暴露显著降低Scnn1b过表达肺的这些数值。此外,与维持在慢性85% Fi O 2暴露下的WT肺相比,转基因Scnn1b肺中参与促纤维化反应基因的mRNA水平显著较低(图1D-F)。通过MS蛋白质组学分析,正常氧下的转基因Scnn1b小鼠的监测BALF肺损伤和应激的标记物水平明显高于WT小鼠,高氧能够进一步诱导这些标记物的水平(图1G-I)。这些结果表明Scnn1b的过表达小鼠表现出肺损伤和炎症水平的升高,但可能对高氧暴露介导的肺损伤/炎症和纤维化具有潜在的保护作用。
 图1 Scnn1b转基因肺在慢性高氧下的表型(图源:Zhang T, et al., Redox Biology, 20
图1 Scnn1b转基因肺在慢性高氧下的表型(图源:Zhang T, et al., Redox Biology, 20
2.高氧诱导下的整体蛋白表达变化
为了识别每种基因型在高氧暴露后丰度发生显著变化的蛋白质,进行了基因本体分析,结果表明“氧化还原过程”是两种基因型共有的最重要且唯一的途径(图2A)。在该途径的两种基因型中都观察到NDUA6和NDUS1,并且每一种在高氧条件下都表现出丰度的减少(图2B)。基于“几丁质分解代谢过程”的恢复,在慢性高氧下转基因Scnn1b小鼠的几丁质分解代谢受到了干扰,包括CHIA、CHIL3和CHIL4的显著下调(图2C)。综上所述,高氧诱导转基因Scnn1b小鼠的蛋白变化比野生型小鼠更多样化。
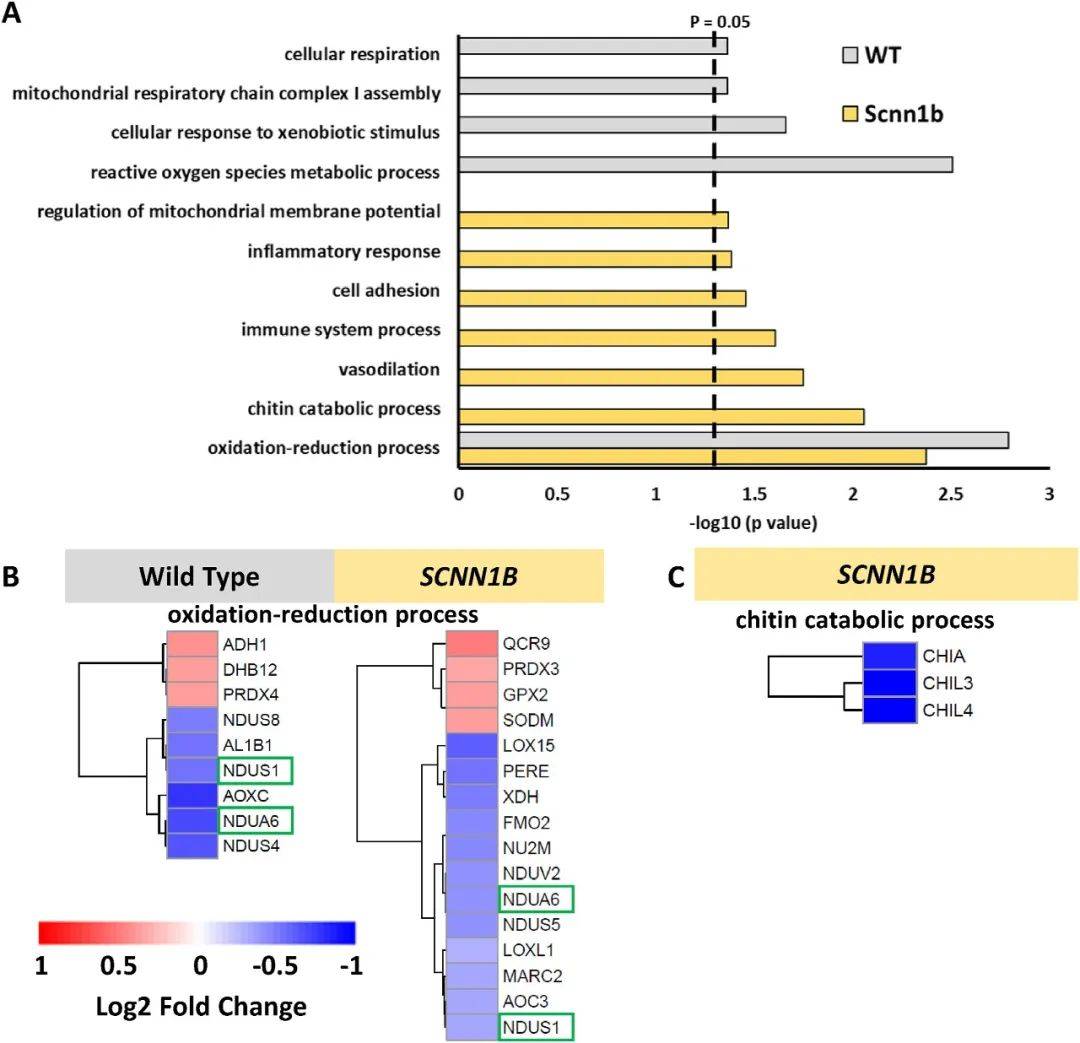 图2 高氧会影响特定生物过程中蛋白质的丰度(图源:Zhang T, et al., Redox Biology, 202
图2 高氧会影响特定生物过程中蛋白质的丰度(图源:Zhang T, et al., Redox Biology, 202
3.高氧诱导的蛋白质SSG修饰的变化
本研究通过差异修饰的Cys位点来确定SSG调节对高氧反应的蛋白质和途径。在SSG修饰中具有显著变化的这些蛋白质的基因本体论表明,高氧条件下多种生物过程在野生型或转基因Scnn1b小鼠中明显过量表达(图3A)。在转基因Scnn1b小鼠中,“细胞粘附”被认为是最具代表性的类别,并且转基因小鼠的Cys位点比野生型小鼠多(图3B)。此外,血液凝固相关的高级生物过程中含有Cys位点的蛋白,在转基因Scnn1b小鼠高氧后主要表现出上调的谷胱甘肽化(图3C)。对“蛋白水解”类别更深入的观察揭示了多种具有SSG水平改变的Cys位点的蛋白质(图3D)。
 图3 高氧影响小鼠肺中与多种生物学过程相关的蛋白质的谷胱甘肽化
图3 高氧影响小鼠肺中与多种生物学过程相关的蛋白质的谷胱甘肽化
4.高氧诱导的蛋白质总氧化的变化
通过测量蛋白质硫醇总氧化来证实关于蛋白质SSG的发现是否正确,结果表明Cys位点的SSG和总氧化数据集之间有很强的相关性(图4A)。这些数据还强调了在SGG或总氧化水平下,其Cys位点氧化水平受到高氧扰动,这表明SSG是蛋白质半胱氨酸氧化水平的检测标准之一(图4B)。
 图4 高氧后过表达Scnn1b小鼠Cys位点的总巯基氧化
图4 高氧后过表达Scnn1b小鼠Cys位点的总巯基氧化
5.TMT蛋白质组的差异调节有助于SCNN1B的保护作用
本研究旨在确定可能有助于上皮钠通道的β亚基(β-ENaC)对高氧诱导的肺损伤的保护作用的蛋白质。总蛋白丰度的分析揭示了两种基因型小鼠之间差异调节的蛋白质。这些蛋白质参与了不同的生物学过程,包括蛋白质折叠、ATP合成和细胞器组织(图5A)。并且其中的许多蛋白质在野生型小鼠中表现出丰度的增加,包括与氧化应激密切相关的蛋白质折叠(图5B-C)。
 图5 过表达Scnn1b导致高氧诱导的蛋白丰度变化的差异调节
图5 过表达Scnn1b导致高氧诱导的蛋白丰度变化的差异调节
PART.03、小结
肺谷胱甘肽修饰蛋白质组与TMT蛋白质组的结果表明高氧不会引起氧化还原稳态的剧烈干扰。此外,Scnn1b过表达可能通过调节细胞粘附、凝血和蛋白水解等特定过程来保护高氧诱导的肺损伤。SSG对特定蛋白质的调节的新发现加深了我们对肺对高 O 2反应的氧化还原调节作用的理解,强调了氧化还原调节在肺部的重要性。
PART.04、拜谱小结
谷胱甘肽(GSH)是哺乳动物细胞内丰度最高的低分子抗氧化剂,对维持细胞氧化还原状态具有重要作用。蛋白质的S-谷胱甘肽修饰可改变蛋白的结构,影响蛋白质的复合体形成以及多种细胞学功能。拜谱生物作为一家国内领先的多组学公司,在半胱氨酸氧化还原修饰领域组积累了丰富的项目经验,成功助力Nature文章发表,可提供棕榈酰化、亚硝基化、谷胱甘肽化、次磺酸化、硫巯基化、Total 氧化还原、游离巯基蛋白质组学检测服务,其中谷胱甘肽修饰蛋白质组目前可鉴定超过2000余种的蛋白质,欢迎大家咨询!
参考文献:Zhang T, Day NJ, Gaffrey M, Weitz KK, Attah K, Mimche PN, Paine R 3rd, Qian WJ, Helms MN. Regulation of hyperoxia-induced neonatal lung injury via post-translational cysteine redox modifications. Redox Biol. 2022; 55:102405. doi: 10.1016/j.redox.2022.102405.