

代谢是所有细胞生命活动的基础,代谢重编程已被证明是肿瘤不同于正常组织的独特特征。因此,抑制肿瘤依赖性代谢,如有氧糖酵解,可以有效地阻断肿瘤生长所需要的能量供应,进而抑制肿瘤生长,这是一个极具有前景的治疗策略。然而,单一抑制有氧糖酵解并不能达到对肿瘤的长效抑制,这是由于肿瘤会利用谷氨酰胺代谢进行能量回补。因此,如何实现依赖性糖酵解和代偿性能量代谢的双重阻断是肿瘤饥饿治疗领域亟需解决的问题。
2023年6月17日,西北工业大学医学研究院戴亮亮团队在Small(IF=13.3)上发表题为“Detachable MOF-Based Core/Shell Nanoreactor for Cancer Dual-Starvation Therapy With Reversing Glucose and Glutamine Metabolisms”的研究文章。研究人员构建MOF纳米反应器体系(PCP-MOF@G@B),提高了肿瘤穿透和细胞摄取效率,诱导线粒体损伤和细胞周期阻滞。通过靶向代谢组学发现PCP-MOF@G@B通过干扰糖酵解和谷氨酰胺代谢途径,抑制肿瘤细胞的能量和生物分子供应。最后,体内实验证实PCP-MOF@G@B对肿瘤有抑制作用。该研究中拜谱生物为其提供MT1000医学广靶代谢组学服务,发现糖酵解和下游途径中差异代谢物,为揭示PCP-MOF@G@B对肿瘤的抑制作用提供有力证据。

文章名称:Detachable MOF-Based Core/Shell Nanoreactor for Cancer Dual-Starvation Therapy With Reversing Glucose and Glutamine Metabolisms(Small,IF=13.3,2023.06)
客户单位:西北工业大学医学研究院
研究对象:MDA-MB-231细胞(人乳腺癌细胞)
分组信息:对照组(Control)、葡萄糖氧化酶-FITC(GOD-FITC)、(装载GOD体系)PCP-MOF@G、(装载GOD和BPTES体系)PCP-MOF@G@B
拜谱生物提供技术:MT1000医学广靶代谢组学
思路流程图
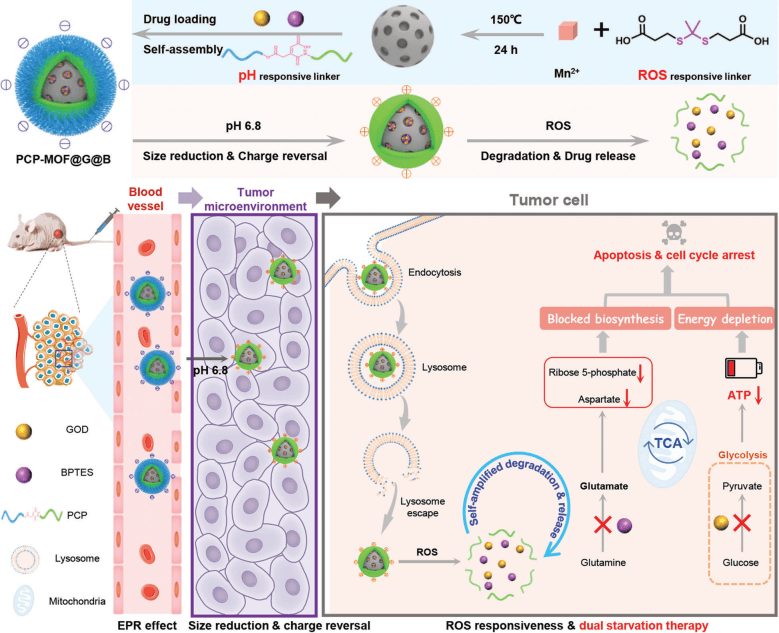 图1| 功能性MOF纳米反应器的构建及其对肿瘤糖酵解和谷氨酰胺代谢的抑制作用
图1| 功能性MOF纳米反应器的构建及其对肿瘤糖酵解和谷氨酰胺代谢的抑制作用
研究结果
研究人员首先开发了一种尺寸/电荷可调的pH/ROS响应性可降解的“核壳型”金属有机框架(MOF)纳米反应器,装载葡萄糖氧化酶(GOD)和谷氨酰胺代谢抑制剂BPTES,GOD能竞争性消耗葡萄糖并产生H2O2,响应性放大纳米体系的解离和药物释放。MOF体系胞内累积释放GOD和BPTES,诱导肿瘤细胞线粒体损伤、周期停滞和凋亡,提高癌细胞杀伤效果。
为了进一步揭示PCP-MOF@G@B对肿瘤细胞糖酵解和谷氨酰胺代谢途径的抑制作用,研究人员对给药24小时后的不同形态的MDAMB-231细胞进行了靶向代谢组学分析。主成分分析(PCA)显示,各给药组的聚类特征不同于对照组和PCP-MOF阴性组,且各聚类样本分离较小(图2A),说明靶向代谢组学分析具有良好的稳定性和有效性。与对照组相比,PCP-MOF@G和PCP-MOF@G@B处理的MDA-MB-231细胞的重编程代谢组学途径发生较大变化,代谢物聚类存在显著差异(图2B-D)。研究人员筛选到糖酵解和下游代谢途径中的8种重要代谢物,包括有氧糖酵解途径中D-葡萄糖6-磷酸和磷酸烯醇丙酮酸,TCA循环中琥珀酸、富马酸和苹果酸,以及生物大分子和核苷酸合成途径中谷氨酸、天冬氨酸和核糖5-磷酸(图2E)。其中,D-葡萄糖6-磷酸和磷酸烯醇丙酮酸的减少表明PCP-MOF@G和PCP-MOF@G@B抑制了MDA-MB231细胞的糖酵解。PCP-MOF@G组谷氨酸水平略有升高,这归因于肿瘤细胞在糖酵解途径被抑制时产生代偿性代谢性谷氨酰胺机制。PCP-MOF@G组中TCA循环的产物琥珀酸和草酰乙酸的含量没有明显降低,这进一步证实了PCP-MOF@G介导的谷氨酰胺代偿代谢和部分能量损失的发生(图2F)。PCP-MOF@G@B不仅显著降低了D-葡萄糖6-磷酸和磷酸烯醇丙酮酸水平,还下调了谷氨酸和TCA循环关键代谢物琥珀酸和草酰乙酸的含量,这证明了糖酵解和谷氨酰胺代谢途径的有效双重抑制以及能阻断量和肿饥饿瘤(图2F)。此外,PCP-MOF@G@B组中核苷酸和其他生物大分子生物合成的关键代谢中间体天冬氨酸和核糖5-磷酸也显著减少,这明显阻碍了肿瘤细胞增殖所需的非必需氨基酸(天冬氨酸)和核苷酸的生物合成,从而导致肿瘤完全饥饿,有效抑制肿瘤增殖。综上所述,PCP-MOF@G@B通过干扰糖酵解和谷氨酰胺代谢途径,抑制肿瘤细胞的能量代谢和生物分子供应。
最后,研究人员构建了乳腺癌肿瘤小鼠模型,证明PCP-MOF@G@B体系介导的双重饥饿治疗能够有效抑制肿瘤生长,并能良好累积于肿瘤病灶,兼顾有效性和安全性。
 图2| 代谢组学分析(图源:Huiping Du, et al., Small, 2023)
图2| 代谢组学分析(图源:Huiping Du, et al., Small, 2023)
拜谱生物小结
研究人员成功构建了一种肿瘤微环境响应性尺寸/电荷可调的可降解MOF纳米反应器给药体系。该药控体系能有效渗透并累积到肿瘤病灶,原位自放大载体降解和药物释放,双重抑制肿瘤依赖性物质和能量代谢,提高药物生物利用度和肿瘤饥饿治疗效果。该研究从细胞代谢角度为发展新型药控体系调控肿瘤精准治疗提供了新策略。这一过程中拜谱生物提供了靶向代谢组学技术服务,拜谱生物已研发完成并建立了完善成熟的转录组学、蛋白组学、代谢组学以及多组学联合产品技术服务体系,欢迎致电咨询!
参考文献:Du H, Meng S, Geng M, Zhao P, Gong L, Zheng X, Li X, Yuan Z, Yang H, Zhao Y, Dai L. Detachable MOF-Based Core/Shell Nanoreactor for Cancer Dual-Starvation Therapy With Reversing Glucose and Glutamine Metabolisms. Small. 2023 Jun 17:e2303253. doi: 10.1002/smll.202303253.